-
NA表示阿伏加德罗常数的值,下列有关说法正确的是
A.1.8 g H2O2所含中子总数为NA
B.1 L 1 mol/L的甲醇水溶液中含有氢原子总数为4NA
C.12 g石墨和C60的混合物中质子总数为6NA
D.反应KIO3+6HI===KI+3H2O+3I2中,生成1 mol I2转移电子的总数为2NA
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的是
①46 g NO2和N2O4的混合气体中含有的原子个数为3NA
②常温下,4 g CH4含有NA个C—H共价键
③10 mL质量分数为98%的H2SO4,加水至100 mL,H2SO4的质量分数为9.8%
④标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
⑤25 ℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA
⑥0.1 mol·L-1 Na2CO3溶液中含有0.1NA个CO32-
⑦1 mol Na2O2与水完全反应时转移电子数为2NA
A.③⑥⑦ B.①②⑤ C.①②④ D.④⑤⑥
难度: 简单查看答案及解析
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 困难查看答案及解析
-
开发新材料是现代科技发展的方向之一。下列有关材料的说法正确的是
A.合成纤维和光导纤维都是有机高分子材料
B.SiO2是人类将太阳能转变为电能的常用材料
C.水晶、玛瑙、水泥和瓷器都是硅酸盐制品
D.氮化硅陶瓷是新型无机非金属材料
难度: 简单查看答案及解析
-
目前,安全生产和食品、药品安全受到人们的高度重视。下列有关说法不正确的是
A.检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3
B.为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们
C.可以用SO2来漂白纸浆、毛、丝、草帽辫等
D.“硫磺”温泉可以医治皮肤病
难度: 简单查看答案及解析
-
下列推断正确的是
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
难度: 中等查看答案及解析
-
下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 B.氯水和活性炭使红墨水褪色
C.漂白粉和钠长期暴露在空气中变质 D.氯水和过氧化钠使品红褪色
难度: 中等查看答案及解析
-
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+)
B.新制氯水使红色布条褪色(HCl)
C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-)
D.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2)
难度: 中等查看答案及解析
-
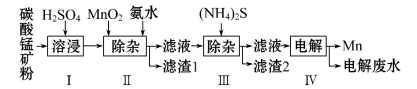
如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是
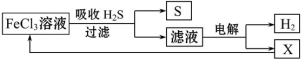
A.吸收H2S的离子方程式为:Fe3++H2S====Fe2++S↓+2H+
B.电解过程中的阳极反应主要为:2Cl--2e-====Cl2↑
C.该工艺流程体现绿色化学思想
D.实验室可用点燃充分燃烧的方法消除H2S污染
难度: 简单查看答案及解析
-
根据海水综合利用的工业流程图,判断下列说法正确的是

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2·6H2O在空气中灼烧即可制得无水MgCl2
C.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D.在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2
难度: 中等查看答案及解析
-
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
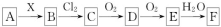
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
选项
a
b
c

A
S
SO2
SO3
B
HNO3
NO
NO2
C
Si
SiO2
H2SiO3
D
NH3
NO2
NO
难度: 中等查看答案及解析
-
在探究SO2性质的实验中,下列说法正确的是
A.SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水
B.SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性
C.SO2气体通入酸性KMnO4溶液中,溶液的颜色变浅,说明SO2具有还原性
D.SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成
难度: 简单查看答案及解析
-
W、X、Y、Z均为的短周期元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是
A. 单质的沸点:W>X B. 阴离子的还原性:W>Z
C. 氧化物的水化物的酸性:W<Z D. X与Y不能存在于同一离子化合物中
难度: 简单查看答案及解析
-
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
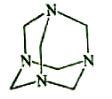
A.1:1 B.2:3 C.3:2 D.2:1
难度: 简单查看答案及解析
-
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2)∶n(FeBr2)=3∶1
C.根据图象无法计算a的值
D.线段Ⅳ表示IO3-的变化情况
难度: 中等查看答案及解析
-
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是
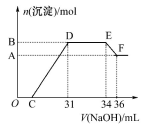
A.OC段离子反应方程式:H++OH-=H2O
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(
)=0.012 mol
D.欲测定F点沉淀的质量,实验步骤是过滤、洗涤、干燥、称量
难度: 简单查看答案及解析
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A.3种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
把一块镁铝合金投入到1 mol/L盐酸中,待合金完全溶解后,再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如右图所示。下列说法中错误的是
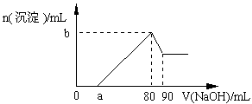
A.盐酸的体积为80 mL
B.a的取值范围为0 < a<50
C.n (Mg2+) < 0.025 mol
D.当a值为30时,b值为0.01
难度: 简单查看答案及解析