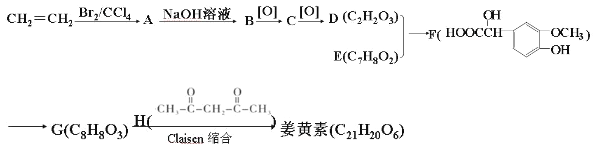
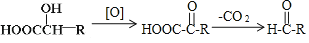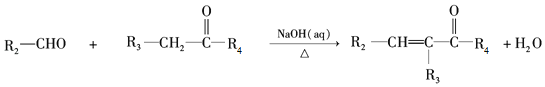-
在通风橱中进行下列实验:
步骤
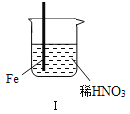
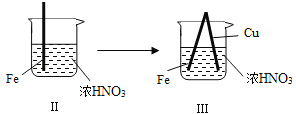
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
难度: 中等查看答案及解析
-
下列各图与表述一致的是( )

A. 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A
B. 用图②所示装置蒸发FeCl3溶液制备无水FeCl3
C. 图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D. 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B
难度: 困难查看答案及解析
-
下列关系中正确的是( )
A. 将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr
B. 常温下,浓度为0.1mol•L﹣1的HA溶液(Ka=10﹣5)pH≈3
C. c(SO32﹣)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3)
D. 25℃时,向10mL0.01mol•L﹣1KOH溶液中滴加10mL0.01mol•L﹣1的醋酸溶液后,混合液中:c(K+)>c(CH3COO﹣)>c(OH﹣)=c(H+)
难度: 困难查看答案及解析
-
在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
…
0.15
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
难度: 困难查看答案及解析