-
下列物质属于溶液的是
A.
 白酒 B.
白酒 B.  豆浆 C.
豆浆 C.  酸奶 D.
酸奶 D.  蒸馏水
蒸馏水难度: 简单查看答案及解析
-
往滴有石蕊的稀盐酸溶液中逐渐滴入氢氧化钠溶液并振荡,直至氢氧化钠过量,可观察到溶液颜色的变化是
A. 红—蓝—紫 B. 红—紫—蓝 C. 蓝—紫—红 D. 蓝—红—紫
难度: 简单查看答案及解析
-
下列做法不利于节能减排、保护环境的是
A. 植树造林 B. 无纸化办公 C. 随意焚烧垃圾 D. 绿色出行
难度: 简单查看答案及解析
-
下列化学肥料中,属于复合肥料的是
A. NH4Cl B. K2SO4 C. KNO3 D. Ca(H2PO4)2
难度: 简单查看答案及解析
-
下列物品所使用的主要材料属于合金的是
A.
 橡胶轮胎 B. 木雕作品
橡胶轮胎 B. 木雕作品 C. 艺术瓷瓶
C. 艺术瓷瓶 D. 青铜摆件
D. 青铜摆件
难度: 简单查看答案及解析
-
下列物质的用途,主要利用了物质化学性质的是
A.水作溶剂 B.熟石灰用于改良酸性土壤
C.氦气用于填充气球 D.铜用于制导线
难度: 简单查看答案及解析
-
根据下表判断,肉类变质过程中酸碱性的变化趋势是
名称
新鲜肉
次鲜肉
变质肉
pH
5.8~6.2
6.3~6.6
>6.7
A. 酸性交弱 B. 碱性变弱
C. 酸性变强 D. 酸性不变
难度: 简单查看答案及解析
-
下列物质放在敞口容器中,一段时间后,质量明显减少的是
A.浓硫酸 B.浓盐酸 C.氯化钠 D.氢氧化钙
难度: 简单查看答案及解析
-
下列四种物质中,能用于区别盐酸、食盐水和烧碱溶液的是
A. 碳酸钠 B. 稀硫酸 C. 紫色石蕊试液 D. 无色酚酞溶液
难度: 中等查看答案及解析
-
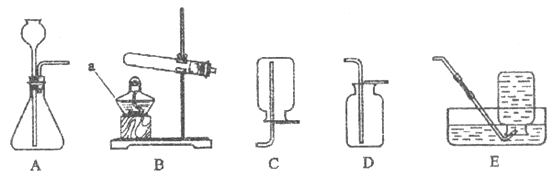
下列实验操作不正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列气体不能用氢氧化钠吸收的是
A. 一氧化碳 B. 二氧化碳 C. 二氧化硫 D. 氯化氢气体
难度: 简单查看答案及解析
-
下列反应中,不属于复分解反应的是
A. MgCl2+2NaOH=Mg(OH)2↓+2NaCl
B. Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
C. 2CuO+C
2Cu+CO2↑
D. CaO+2HCl=CaCl2+H2O
难度: 中等查看答案及解析
-
下列“家庭小实验”中,不能达到预期目的的是
A. 用某些植物的花瓣制酸碱指示剂
B. 用碎鸡蛋壳和食盐水制二氧化碳
C. 用柠檬酸、果汁、白糖、水、小苏打等自制汽水
D. 用塑料瓶、小卵石、石英砂、活性炭、膨松棉、纱布等制作简易净水器
难度: 中等查看答案及解析
-
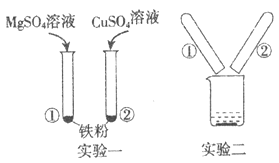
某同学为研究氢氧化钠溶液与稀盐酸是否恰好中和时,取少量反应后的溶液于试管中分别用不同试剂进行实验。下列实验方法及结论不正确的是
实验序号
所用试剂
现象及结论
A
铁粉
有气泡产生,则稀盐酸过量
B
pH试纸
测得pH>7,则氢氧化钠溶液过量
C
无色酚酞溶液
溶液为无色,一定恰好中和
D
紫色石蕊试液
溶液为紫色,一定恰好中和
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关浓硫酸的相关实验,其中合理的是
序号
实验目的
实验过程
①
稀释浓硫酸
取少量浓硫酸放入烧杯中,缓慢倒入水,并用玻璃棒搅拌
②
证明腐蚀性
取少量浓硫酸,滴在纸张或木片上
③
证明吸水性
取少量浓硫酸,置于空气中一段时间,其溶质质量分数减小
④
除氢气中的水分
将混合气体通过盛有浓硫酸的洗气瓶,并用向上排气法收集
A. ②③ B. ①③ C. ②④ D. ①④
难度: 中等查看答案及解析
-
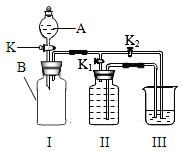
某兴趣小组设计的小实验,装置如图所示。打开止水夹,将A滴入试管①中,A与B接触后,在试管②中的导管口处观察到有气泡冒出。下列液体A和固体B的组合不可能出现上述现象的是

A. 水和烧碱
B. 稀硫酸和镁条
C. 稀盐酸和小苏打
D. 水和硝酸铵
难度: 中等查看答案及解析
-
下表为氯化铵和氯化钠在不同温度时的溶解度。下列说法正确的是( )
温度/℃
0
10
20
30
40
50
NH4Cl
溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
NaCl
溶解度/g
35.7
35.8
36.0
36.3
36.6
37.0
A. 20 ℃,氯化钠饱和溶液的溶质质量分数为36%
B. 由表中数据可知,溶解度受温度变化影响较大的物质是氯化钠
C. 氯化钠与氯化铵溶解度相等的温度在10 ℃~20 ℃之间
D. 50 ℃时,100 g水中加入50.0 g氯化铵配成溶液,再冷却到20 ℃,能够析出13.2 g固体
难度: 困难查看答案及解析
-
下列实验方案能达到实验目的是
选项
实验目的
实验方案
A.
证明某气体是一氧化碳
将该气体通入灼热的氧化铜粉末,黑色粉末变红
B.
证明酸和碱恰好中和
向含有酚酞的氢氧化钠溶液中加入盐酸,溶液最终呈无色
C.
证明燃烧的条件之一是可燃物与氧气接触
将白磷放入80℃热水中,不燃烧,通入氧气后白磷燃烧
D.
证明金属的活动性顺序为Fe>Cu>Ag
将两根光亮铁丝分别伸入硝酸银和硫酸铜的溶液中,硝酸银溶液中的铁丝表面有银白色固体附着,另一铁丝表面有红色固体附着
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列四个图像中,能正确反映对应变化关系的是




A. 向一定量的稀盐酸中加入氧化铁
B. 向一定量的氢氧化钠溶液中滴加稀盐酸
C. 向一定量的硫酸铜溶液中加入铁粉
D. 向一定量的氢氧化钠和氢氧化钙的混合溶液中通入二氧化碳
A. A B. B C. C D. D
难度: 困难查看答案及解析