-
如图是四种常见饮料的pH,其中呈碱性的饮料是( )

A.可乐 B.橙汁 C.牛奶 D.苏打水
难度: 简单查看答案及解析
-
如图为某原子的结构示意图,该原子的原子核中有( )

A.6个质子和8个中子
B.8个质子和6个中子
C.6个质子和8个电子
D.8个质子和6个电子
难度: 简单查看答案及解析
-
实验室中各种化学药品需要合理保存,否则容易变质。硝酸通常存放在棕色试剂瓶中,其原因是硝酸在光照下会发生如下反应:4HNO3
4NO2↑+2H2O+O2↑,该反应属于( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
难度: 简单查看答案及解析
-
下列物质的性质与用途的对应关系错误的是( )
选项
性质
用途
A
氢氧化钙呈碱性
改良酸性土壤
B
浓硫酸具有脱水性
干燥氧气
C
稀盐酸能与某些金属氧化物反应
除铁锈
D
氢氧化钠能与某些非金属氧化物反应
吸收二氧化硫
难度: 简单查看答案及解析
-
为了验证“Fe,Cu,Ag三种金属的活动性由强到弱”,小明设计了如图所示的实验,其中可以达到实验目的组合是( )
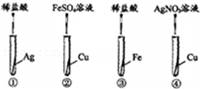
A.①② B.①③ C.②④ D.③④
难度: 中等查看答案及解析



