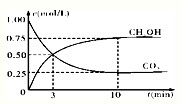
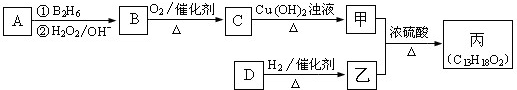
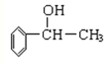
-
下列叙述正确的是( )
A.明矾和Cl2常用于自来水的净化和杀菌消毒,两者的反应原理相同
B.工业上制备镁是用电解熔融的MgCl2来完成的
C.北京时间3月11日,日本地震引起核泄漏,产生的粉尘中含有较多的131I,这是一种质子数为131的一种核素
D.用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3难度: 中等查看答案及解析
-
用NA 代表阿伏加德罗常数,下列说法中不正确的是( )
A.14g乙烯和14g聚乙烯所含原子数均为3NA
B.同温同压下,2.24LN2和2.24LCO所含质子数均为1.4NA
C.1molNa2CO3固体中所含CO32-的数目小于NA
D.常温常压下,1mol重水(D2O)所含电子总数为10NA难度: 中等查看答案及解析
-
有机物种类繁多,性质变化复杂,下列关于有机物的说法错误的是( )
A.肥皂是高级脂肪酸与甘油的酯化产物
B.加热能杀死病毒是因为病毒的蛋白质受热变性
C.乙醇、乙酸和乙酸乙酯能用饱和碳酸钠溶液鉴别,也可以用闻气味的方法鉴别
D.煤的干馏、煤的气化和液化均是化学变化难度: 中等查看答案及解析
-
缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液.下列有关该缓冲溶液的说法错误的是( )
A.加入少量强碱,发生反应HPO42-+OH-=PO43-+H2O
B.加入少量强酸,发生反应HPO42-+H+=H2PO4-
C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)
D.c(Na+)/2>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>c(Na+)/3难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
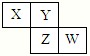
A.只由这四种元素不能组成有机化合物
B.最高价氧化物对应水化物的酸性W比Z弱
C.Z的单质与氢气反应较Y剧烈
D.X、Y形成的化合物都易溶于水难度: 中等查看答案及解析
-
混合动力车的电动机目前一般使用的是镍氢电池,在上坡或加速时,电池处于放电状态,
在刹车或下坡时电池处于充电状态.镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液.镍氢电池充放电原理如图,其总反应式为:
H2+2NiOOH2Ni(OH)2
下列有关混合动力车的判断正确的是( )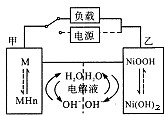
A.在上坡或加速时,乙电极周围溶液的pH将减小
B.在刹车和下坡时,乙电极增重
C.在上坡或加速时,溶液中的K+向甲电极迁移
D.在刹车和下坡时,甲电极的电极反应式为2H2O+2e-=H2↑+2OH-难度: 中等查看答案及解析
-
“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如表:
下列关于该实验的分析正确的是( )实验编号 ① ② ③ ④ ⑤ c(I-)mol/L 0.040 0.080 0.080 0.160 0.160 c(S2O82-)mol/L 0.040 0.040 0.080 0.020 0.040 t/s 88.0 44.0 22.0 44.0 t2
A.该实验的目的是探究反应物的浓度对反应速率的影响
B.显色时间t2=44.0s
C.若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为>22.0s
D.通过分析比较上表数据得到的结论是升高温度反应速率加快难度: 中等查看答案及解析