-
下列实验操作正确的是
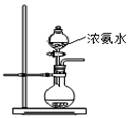
A.可用氨水除去试管内壁上的银镜
B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中
C.将三氯化铁溶液蒸干,可制得无水三氯化铁
D.锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜
难度: 简单查看答案及解析
-
某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是
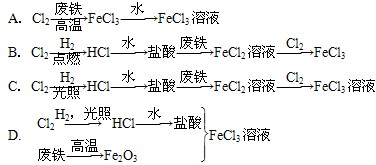
难度: 简单查看答案及解析
-
下列实验设计能够成功的是
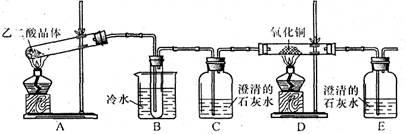
A.检验亚硫酸钠试样是否变质:试样
 沉淀不溶解
沉淀不溶解B.除去乙酸乙酯中混有的乙酸:混合液
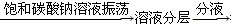 得上层液体
得上层液体C.证明酸性条件下H2O2氧化性比I2强: NaI溶液
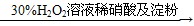 溶液变蓝色
溶液变蓝色D.鉴定盐A的成分是FeBr2:
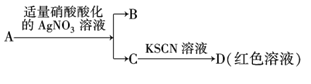
难度: 简单查看答案及解析
-
下列实验能达到目的的是
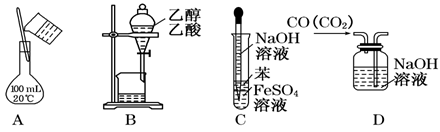
A.配制150 mL 0.10 mol/L盐酸 B.除去乙醇中的乙酸
C.制备Fe(OH)2 D.除去CO中的CO2
难度: 简单查看答案及解析
-
用下列实验装置完成对应的实验,操作正确并能达到实验目的的是

难度: 简单查看答案及解析
-
下列实验设计和结论相符的是
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到
较纯净的FeCl3溶液
难度: 简单查看答案及解析
-
下列各组稀溶液中,利用组内物质的相互反应,就能将各种物质鉴别的是
A.NaOH、CuSO4、HCl、KNO3 B.HCl、KOH、NaCl、Na2SO4
C.Ca(OH)2、Na2CO3、NaCl、HCl D.NaNO3、MgCl2、KCl、Ba(OH)2
难度: 简单查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体
HNO3分解生成了NO2
B
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成。
淀粉没有水解成葡萄糖
C
向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 。
使溶液褪色的气体是乙烯
D
向饱和Na2CO3中通入足量CO2 ,溶液变浑浊
析出了NaHCO3
难度: 简单查看答案及解析