-
下列实验中的操作过程中均必须要用到的仪器是
①配制一定物质的量浓度的溶液 ②用pH试纸测定溶液的pH ③过滤 ④蒸发 ⑤硫酸铜晶体里结晶水含量的测定
A. 烧杯 B. 玻璃棒
C. 胶头滴管 D. 漏斗
难度: 简单查看答案及解析
-
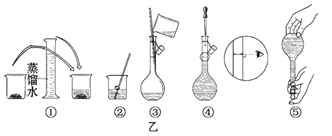
下图中所示的实验方法、装置、操作或标签正确的是
A. 制备并检验氢气的可燃性
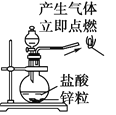 B. 装有酒精的试剂瓶上要贴有危险标签
B. 装有酒精的试剂瓶上要贴有危险标签 C. 赶去碱式滴定管中的气泡
C. 赶去碱式滴定管中的气泡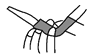 D. 除去乙烷中的乙烯
D. 除去乙烷中的乙烯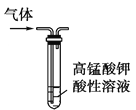
难度: 简单查看答案及解析
-
实验室中,下列试剂的保存方法不正确的是
A. 液溴需加水密封保存
B. 浓硝酸保存在棕色细口瓶中
C. 金属钠保存在煤油中
D. 碳酸钠溶液保存在配有磨口玻璃塞的试剂瓶中
难度: 简单查看答案及解析
-
下列物质的分离(或提纯)方法正确的是
A. 分离汽油和水--分液
B. 除去氯化钠溶液中的泥沙--蒸馏
C. 分离乙酸与乙酸乙酯--萃取
D. 用四氯化碳提取溴水中的溴单质--过滤
难度: 简单查看答案及解析
-
三聚氰胺事件,使中国乳业多年走在阴影之中,现已步入复苏。三聚氰胺又名蛋白精[分子式为C3N3(NH2)3,相对分子质量:126]是一种低毒性化工产品,婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺说法正确的是( )
A. 2.52 g三聚氰胺含氮原子数目为0.12NA
B. 标准状况下,1 mol三聚氰胺的体积为22.4 L
C. 三聚氰胺含氮量约为10%
D. 三聚氰胺的摩尔质量为126 g
难度: 简单查看答案及解析
-
[2016全国Ⅲ]下列有关实验的操作正确的是
实验
操作
A.
配制稀硫酸
先将浓硫酸加入烧杯中,后倒入蒸馏水
B.
排水法收集KMnO4分解产生的O2
先熄灭酒精灯,后移出导管
C.
浓盐酸与MnO2反应制备纯净Cl2
气体产物先通过浓硫酸,后通过饱和食盐水
D.
CCl4萃取碘水中的I2
先从分液漏斗下口放出有机层,后从上口倒出水层
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法中,正确的是
A. 18gD2O中含有的电子数目为10NA
B. 标准状况下,22.4 L苯含有的原子数目为12NA
C. 常温下,1 L 0.1 mol/L AlCl3溶液中,Al3+的数目为0.1NA
D. 0.78gNa2O2与足量的水反应转移电子数目为0.01NA
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1 mol烷烃 CnH2n+2中,共价键数目为(3n+1)NA
B. 4.48 L氨气分子中含0.6NA个N—H键
C. pH=1的盐酸中含有的H+离子数为0.1NA
D. 标准状况下,22.4 L二氯甲烷的分子数约为4NA个
难度: 中等查看答案及解析
-
如图表示1 g O2与1 g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是

A. C2H4 B. CH4
C. CO2 D. NO
难度: 中等查看答案及解析
-
可用如图装置制取、净化、收集气体的是
选项
气体
①
②
③
A
NH3
浓氨水
生石灰
浓硫酸
B
SO2
浓硫酸
Na2SO3
浓硫酸
C
NO2
浓硝酸
铜屑
H2O
D
Cl2
浓盐酸
MnO2
H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,如果a g某双原子分子气体的分子数为p,则b g该气体在标准状况下的体积V(L)是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
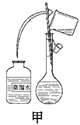
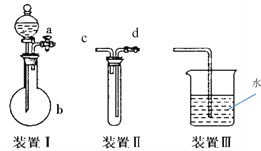
下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
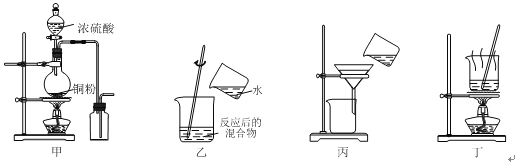
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
难度: 中等查看答案及解析
-
在标准状况下,将V L A气体(摩尔质量为M g·mol-1)溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度(mol·L-1)为
A.
B.
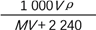
C.
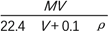 D. 1 000VρM(MV+2 240)
D. 1 000VρM(MV+2 240)难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 2 mol SO2和1 mol O2在一定条件下充分反应后,混合物的分子数为2NA
B. 标准状况下,22.4 L NO2气体中所含分子数目为NA
C. 100 g 17%的氨水,溶液中含有的NH3分子数小于NA
D. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
难度: 中等查看答案及解析
-
下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。

在上述实验过程中,所涉及的三次分离操作分别是
A. ①蒸馏 ②过滤 ③分液 B. ①分液 ②蒸馏 ③蒸馏
C. ①蒸馏 ②分液 ③分液 D. ①分液 ②蒸馏 ③结晶、过滤
难度: 中等查看答案及解析
-
将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是
A. q=2p B. q>2p C. q<2p D. 无法确定
难度: 困难查看答案及解析