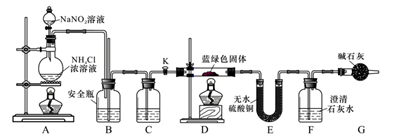
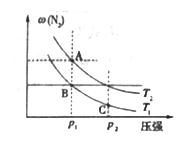
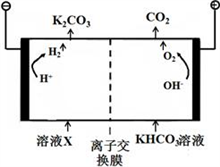
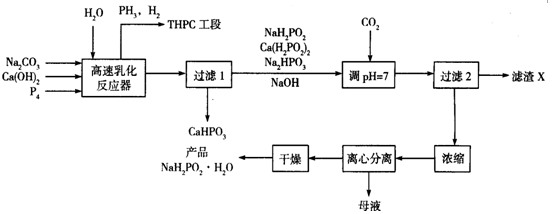
-
化学与科技、生产、生活等密切相关,下列说法正确的是
A. 中国的圆珠笔头一直需要进口笔尖钢,经过5年数不清的失败, 2016年9月,中国太钢集团利用家常和面原理在钢水中加入添加剂试验成功,造出圆珠笔头,可完全替代进口。由此信息可知笔尖钢为合金,且具有良好的切削性。
B. 日前从中国建筑材料科学研究总院获悉,天宫二号采用了该院研发改进的新材料,耐辐射石英玻璃,其主要成分为硅。
C. 用废轮胎、废电缆打碎制成的塑胶跑道,可以提高原子利用率
D. 塑化剂DEHP邻苯二甲酸二(2-乙基)己脂,对人体无害,可用作食品添加剂。
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1.0 L 0. 5mol/L的Na2SO4水溶液中含有的氧原子数为2NA
B. 用含有0.2mo1 FeCl3的饱和溶液配制的氢氧化铁胶体中胶粒数等于0.2NA
C. 1. 0gH218O与D2O的混合物所含中子数为0.5NA
D. 标准状况下,11.2L氯气与足量铁粉充分反应,转移的电予数为1.5NA
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 将苯加入溴水中振荡后,水层接近无色,是因为发生了取代反应。
B. —体积某气态烃与HC1充分加成消耗HC1 —体积,加成后的物质最多还能和5体积氯气发生取代反应,由此推断原气态烃是乙烯。
C. 环己醇能与氢氧化钠溶液反应且所有碳原子可以共面。
D. 等质量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同.
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
B
C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液
KMnO4溶液褪色
使KMnO4溶液褪色的气体一定是乙烯
C
铜放入稀硫酸中,再加入硝酸钠固体
开始无明显现象,后溶液变蓝,有气泡放出,铜溶解
硝酸钠可以加快铜与稀硫酸的反应速率
D
向浓度均为0.1 mol/L NaCl和Nal混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强
B. 原子半径X>Y,离子半径X+>Z2-
C. 同族元素中Z的氢化物稳定性最高
D. 同周期元素中Y的最高价含氧酸的酸性最强
难度: 中等查看答案及解析
-
以下有机物同分异构体数目判断中不正确的是
A. 立方烷(
 )的六氨基(-NH2)取代物有3种。
)的六氨基(-NH2)取代物有3种。B. C3H7ClO(有羟基)的同分异构体数目有5种
C. 甲苯与氢气充分加成后的—溴代物有4种。
D. 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种。
难度: 困难查看答案及解析
-
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/mol·L-1
反应后溶液的PH
c(HA)
c(KOH)
①
0.1
0.1
9
②
X
0.2
7
下列判断不正确的是
A. 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B. 实验①反应后的溶液中:c(OH-)= c(K+)-c(A_)=
mol·L-1
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)> c(OH-)=c(H+)
难度: 中等查看答案及解析