-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项
事实
推测
A
12Mg与水反应缓慢,20Ca与水反应较快
56Ba(第ⅡA族)与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1 500 ℃时分解,HI在230 ℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列设备工作时,将化学能转化为热能的是

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是
A. 元素原子核外电子层排布呈周期性变化
B. 元素相对原子质量依次递增
C. 元素原子半径大小呈周期性变化
D. 元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一密闭容器中进行,下列条件的改变能加快反应速率的是
A. 增加C的量
B. 将容器的体积缩小一半
C. 保持容器体积不变,充入N2
D. 保持压强不变,降低容器内的温度
难度: 简单查看答案及解析
-
关于含阳离子O2+的化合物O2AsF6,下列叙述中错误的是
A. 化合物O2AsF6为离子化合物
B. 化合物中含有离子键、极性共价链、非极性共价键
C. 化合物O2AsF6中As的化合价为+5价
D. 1摩尔O2+含有11摩尔核外电子
难度: 中等查看答案及解析
-
A、B、C、D四种金属分别用导线两两相连浸入电解液中组成原电池。A、B相连时,A为负极;C、D相连时,电流由D流到C;A、C 相连时,C极上有大量气泡;B、D相连时,D极发生氧化反应。据此判断四种金属的活动性顺序是
A.A>C>D>B B.D>A>B>C C.A>D>C>B D.C>B>A>D
难度: 简单查看答案及解析
-
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体积已转换为标准状况。下列说法正确的是

A. a电极的电极材料是铜
B. 如果将稀硫酸换为CuSO4溶液,则不能达到实验目的
C. 锌与稀硫酸反应时放出的热量对实验测定不产生影响
D. 若量筒中收集到aLH2,则电解质溶液中通过了a/11.2mol电子
难度: 中等查看答案及解析
-
反应A+3B═2C+2D在四种不同情况下的反应速率分别为: ① υ(A)=0.15mol•L—1•s—1 ② υ(B)=0.6mol•L—1•s—1 ③ υ(C)=0.4mol•L—1•s—1 ④ υ(D)=0.45mol•L—1•s—1。该反应进行的快慢顺序为
A. ②>④>③>① B. ④>③=②>① C. ①=②=③=④ D. 无法判断
难度: 中等查看答案及解析
-
下列叙述正确的有___个
①两种原子构成的共价化合物分子中的化学键都是极性健
②两个不同种非金属元素的原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物
④只要是离子化合物,其熔点就比共价化合物的熔点高
⑤难失去电子的原子,一定易形成阴离子
⑥单质分子中不存在化学键,化合物的分子中才存在化学键
⑦离子化合物中一定含有离子键
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
在如图所示的8个装置中,属于原电池且A1作负极的是
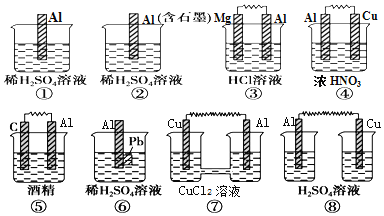
A. ②⑥⑦ B. ③④⑤ C. ④⑧ D. ②④⑥⑦
难度: 简单查看答案及解析
-
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化
B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等
D. 单位时间内生成1 mol Y的同时生成2 mol X
难度: 中等查看答案及解析
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为80%
C. 2 min内A的平均反应速率为0.3 mol·(L·min)-1
D. 若混合气体的密度不变则表明该反应达到平衡状态
难度: 简单查看答案及解析
-
对于反应2SO2+O2
2SO3,下列判断正确的是
A. 2 mol SO2和5 mol O2充分反应可生成2 mol SO3
B. 2 mol SO2和1mol O2达到化学平衡时SO2、O2、SO3的分子数之比一定为2∶1∶2
C. 达到化学平衡时SO2的消耗速率必定等于O2的生成速率的2倍
D. 三种物质的浓度相等时,说明反应达到了化学平衡。
难度: 困难查看答案及解析
-
下列过程中,共价键被破坏的是
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水⑤冰融化 ⑥NH4Cl“升华”⑦氢氧化钠熔化 ⑧(NH4)2SO4溶于水
A. ①④⑥⑦ B. ④⑥⑧ C. ①②④⑤ D. ④⑥
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
A. 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加
B. 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L
C. 根据化学反应速率的大小可以知道化学反应的相对快慢
D. 对于任何化学反应来说,反应速率越大,反应现象越明显
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
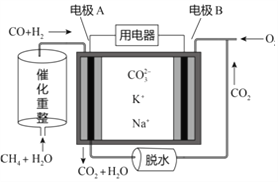
A. CH4+H2O
3H2+CO,当有1 mol CH4参加该反应,则转移12 mol电子
B. 电极A为正极
C. 电池工作时,CO32-向电极B移动
D. O2在B电极上被还原
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A.
O和
O中子数相同,质子数不同,互为同位素
B.
F-质量数为19,电子数为9
C. Na2O2晶体中阳离子与阴离子个数比为2∶1
D. MgCl2晶体中既存在离子键又存在共价键
难度: 中等查看答案及解析
-
部分短周期元素的原子半径及主要化合价如下,根据表中信息,判断以下叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0. 143
0.112
0. 104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的稳定性为H2T<H2R B. 单质与稀盐酸反应的剧烈程度为L<Q
C. M与T形成的化合物具有两性 D. L2+与R2-的核外电子数相等
难度: 中等查看答案及解析
-
在一密闭容器中进行该反应:2SO2(g)+O2(g)
2SO3(g),已知反应中某一时刻SO2、O2、SO3的浓度为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L、O2为0.2mol/L
B. SO2为0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
难度: 简单查看答案及解析
-
等质量并且均过量的两份锌粉a和b(粉末表面积可视为相同,分别加入等体积等物质的量浓度的稀硫酸中,同时向a中加入少量硫酸铜,下图表示产生H2的体积(V)与时间(t)的关系正确的是
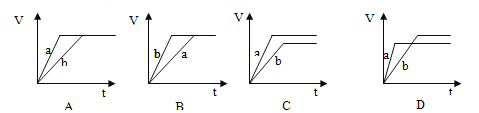
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )

A. 简单离子的半径:X<Z<M
B. 最高价氧化物对应水化物的酸性:R<N
C. Y、R两种元素的气态氢化物稳定性:Y>R
D. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
难度: 简单查看答案及解析
-
现有反应 3Fe(s)+ 4 H2O(g)
Fe3O4(s)+4 H2(g),在一体积可调的密闭容器中进行,采取下列措施对其反应速率几乎无影响的是( )
A. 增加H2的量
B. 将容器体积缩小一半
C. 保持容器内体积不变,充入Ar使体系压强增大
D. 充入Ar,保持容器内压强不变
难度: 中等查看答案及解析
-
氢化铵(NH4H)与氯化铵结构相似,又已知NH4H与水反应有氢气产生,下列叙述中不正确的是 ( )
A. NH4H是由NH
和H-构成的
B. NH4H固体投入少量水中,有两种气体产生
C. NH4H中的H-半径比锂离子半径大
D. NH4H溶于水后,形成的溶液显酸性
难度: 困难查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的放电的总反应为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A. 放电时负极反应式为:3Zn-6e-+6OH-=3Zn(OH)2
B. 放电时正极反应式为:2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-
C. 放电时每转移3mol电子,正极有lmolK2FeO4被氧化
D. 放电时K+向正极移动,且正极附近溶液的碱性增强
难度: 中等查看答案及解析
-
用CH4催化还原NOX可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ•mol-1
已知NO、 NO2混合气体的密度是相同条件下氢气密度的17倍,16g甲烷和该混合气体恰好完全反应生成N2、 CO2、H2O(g)放出1042.8 kJ的热量,则△H1是( )
A.-574kJ•mol-1 B.-691.2kJ•mol-1 C.-867kJ•mol-1 D.-925.6kJ•mol-1
难度: 中等查看答案及解析