-
NA表示阿伏加德罗常数,下列说法正确的是
A.常温常压下,11.2 L氯气所含原子数目为NA
B.2 L 0.2 mol / L K2SO4溶液
物质的量浓度为0.4 mol / L
C.1 mol Na作还原剂可提供电子数为2NA
D.同温、同压下NA个CO2分子和NA个O2分子的体积相同
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.NO2通入水溶液中:3NO2+H2O=2NO3-+NO+2H+
B.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O
C.过量NaOH滴入NH4HCO3稀溶液中:NH4++OH-=NH3·H2O
D.铜片加入稀HNO3中:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
难度: 中等查看答案及解析
-
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、SiO32-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、ClO-、K+
难度: 简单查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
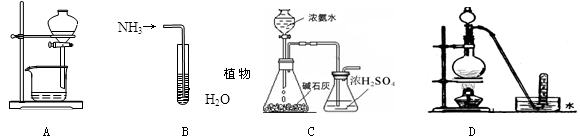
A.放出碘的四氯化碳溶液 B.吸收NH3
C.制取氨气 D.铜与浓硝酸反应制NO2
难度: 简单查看答案及解析
-
下列反应中,属于吸热反应的是
A.食物的腐败 B.铝与稀盐酸反应
C.二氧化碳与碳反应生成一氧化碳 D.甲烷在氧气中的燃烧
难度: 简单查看答案及解析
-
下列关于反应热的说法正确的是
A.当△H为“一”时,表示该反应为吸热反应
B.已知
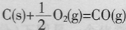 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol
的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/molC.反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小
D.反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
难度: 简单查看答案及解析
-
下图是198K 时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
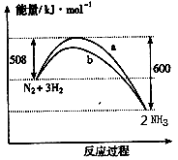
A.该反应的热化学方程式为:N2 + 3H2
2NH3, △H = -92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂, 该化学反应的反应热改变
D.在温度、体积一定的条件下,通入lmol N2和3molH2 反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
难度: 中等查看答案及解析
-
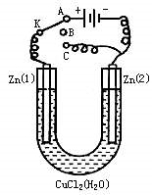
某兴趣小组设计如图所示的微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A.断开K2,闭合K1时,总反应的离子方程式为:2H+ + 2Cl-
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为: Cl2+2e-=2Cl-
D.断开K1,闭合K2时,石墨电极作正极
难度: 中等查看答案及解析
-
现有分别放置下图装置(都盛有稀H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是

难度: 中等查看答案及解析
-
在一定温度不同压强(P1<P2)下,可逆反应2A(g)
2B(g) + C(g)中,生成物C在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是

难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的pH=7
C.混合溶液中,
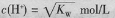
D.混合溶液中,
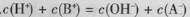
难度: 简单查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应: Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。

下列判断正确的是
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0
D.25℃时,该反应的平衡常数K=2.2
难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。下列叙述中不正确的是
A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小
B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大
C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+)
D.溶液中由水电离出的c(H+),前者是后者的10m-n倍
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g)
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(C)=0.4 mol / (L·s) B.υ(B)=0.45 mol / (L·s)
C.υ(A)=0.15 mol / (L·s) D.υ(D)=0.35 mol / (L·s)
难度: 简单查看答案及解析
-
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是
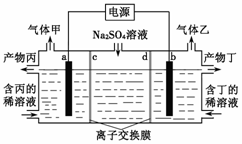
A.a极与电源的负极相连 B.产物丙为硫酸溶液
C.离子交换膜d为阴离子交换膜 D.a电极反应式:2H2O+2e-= H2↑+2OH-
难度: 中等查看答案及解析