-
化学与人类生活、社会可持续发展密切相关。下列变化不属于化学研究范畴的是( )
A. MERS病毒疫苗的研制 B. 朝鲜的原子弹爆炸实验
C. 近期出现雾霾的原因探究 D. 马鞍山钢铁厂冶炼铁
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法中不正确的是 ( )
A. 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA
B. 一定条件下,2.3g的Na完全与O2反应生成Na2O或Na2O2时失去的电子数均为0.1NA
C. 2.8 g CO和N2的混合气体中所含电子总数为1.4NA
D. 甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA
难度: 中等查看答案及解析
-
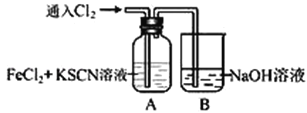
下列图示实验操作正确的是 ( )
A.
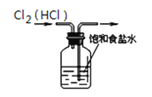 除去Cl2中的HCl B.
除去Cl2中的HCl B. 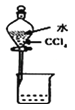 分离CCl4和水 C.
分离CCl4和水 C. 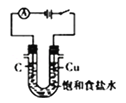 电解制Cl2和H2 D.
电解制Cl2和H2 D.  中和热的测定
中和热的测定难度: 中等查看答案及解析
-
下列关于实验的叙述正确的是 ( )
A. 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明氧化性:Br2>Fe3+>I2
B. 检验NH4Al(SO4)2溶液中的NH4+:取样于试管中,向溶液中加入少量NaOH溶液,加热,用湿润的红色石蕊试纸检验产生的气体
C. 检验FeBr2溶液中的Fe2+:一般不能使用酸性高锰酸钾溶液
D. 检验Na2S2O3和Na2SO4的混合溶液中的SO42-:先加足量稀盐酸,再加氯化钡溶液
难度: 困难查看答案及解析
-
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是 ( )
A. d的最高价含氧酸的酸性强于c的最高价含氧酸的酸性
B. 它们均存在两种或两种以上的氧化物
C. 只有a与其他元素生成的化合物都是离子化合物
D. b、c、d分别与氢元素形成的化合物中化学键均为极性共价键
难度: 中等查看答案及解析
-
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,H2SO4作为电解质。下列关于该燃料电池的叙述正确的是 ( )

A. 电流从左侧电极经过负载后流向右侧电极
B. 该燃料电池正极发生的电极反应式为N2H4-4e-N2↑+4H+
C. 利用该燃料电池工业上可以电解熔融MgCl2 制备Mg
D. 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小
难度: 中等查看答案及解析
-
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法正确的是 ( )
A. 由反应可确定:氧化产物是HClO4
B. 由非金属性Cl>S,可推知酸性HClO3>H2SO4
C. 若化学计量数a=8,b=3,则该反应转移电子数为8e-
D. 若该反应所得lmol混合气体质量为45g,则反应可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O
难度: 困难查看答案及解析