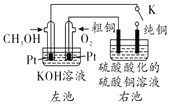
-
软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:
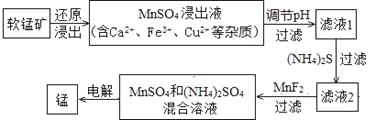
下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
软锰矿还原浸出的反应为:12MnO2+ C6H12O6+ 12H2SO4=12MnSO4+ CO2↑+18H2O
①该反应中,还原剂为__________。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_____________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq) Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
-
碳、氮和氯元素及其化合物与人类的生产、生活密切相关。
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
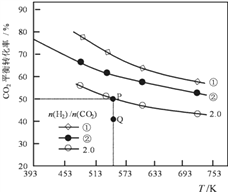
在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g)  C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
(1)反应的△H_____0,氢碳比①________②,Q点v(正)_____v(逆)(填“大于”或“小于”)
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为_____________________。
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为_______________________________________________________。
| 化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
| 键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
_________________________________________________________。
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=_________mol/L.将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=_____________.
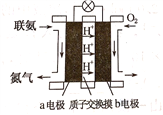
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为____________极(填“正”或“负”),写出该电池工作时a电极的电极反应式___________________________________________.
-
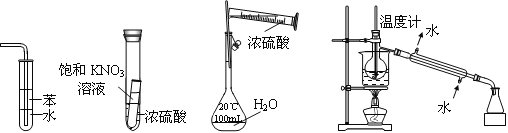
某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹):

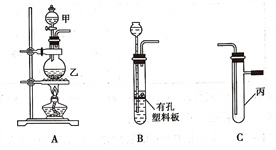
(1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后__________________________________________,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有__________________________________(任写两种即可)。
(3)用锌粒和稀硫酸制备H2时应选用装置________作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是___________________________。
(4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。
①A中玻璃仪器乙的名称为______________________,A装置中发生反应的离子方程式为
_____________________________________________。
②C中说明Cl-和S2-的还原性强弱的实验现象是_______________________________________。
(5)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置中发生反应的离子方程式为________________________________________________。
②反应一段时间后D装置中的具支试管丁中收集满NO2气体,若进行NO2气体与水反应的实验,应____________________________________(填对a、b、c三个止水夹进行的操作),然后再适当加热丁。实验现象为____________________________________________________________。
-
X、Y、Z、U、W 是原子序数依次增大的前四周期元素。其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子。请回答下列问题:
(1)U 在周期表中的位置 。X、Y、Z 的第一电离能从大到小的顺序是 (用元素符号表示,下同)。
(2)写出 W 的价电子排布图 。
(3)根据等电子体原理,可知化合物 XZ 的电子式是 。
(4)X、Y、Z的最简单氢化物的键角从大到小的顺序是 ( 用化学式表示), 原因 是 。
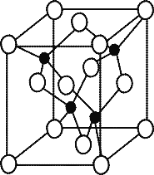
(5)由元素 Y 与 U 元素组成的化合物 A,晶胞结构如右图所示(黑球表示 Y 原子, 白球表示 U 原子),请写出化合物 A 的化学式 ,其中 Y 元素的杂化方式是 。
(6)U 的晶体属立方晶系,其晶胞边长为 405 pm,密度是 2.70 g/cm,通过计算确定 其晶胞的类型 (填简单立方堆积、体心立方堆积或面心立方最密堆 积)(已知:4053≈6.64×107)
-
伪麻黄碱(D)是新康泰克的成分之一,能够缓解感冒时带来的鼻塞、流鼻涕和打喷嚏等症状,其中一种合成路线如下:
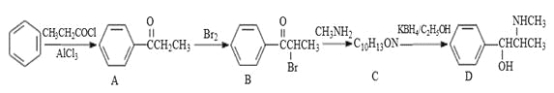
回答下列问题:
(1)伪麻黄碱(D)的分子式为 ;B中含有的官能团有 (写名称)。
(2)写出 B—C反应的化学方程式: 。C—D的反应类型为 。
(3)B的消去产物可以用于合成高分子化合物E,请写出 E的结构简式: 。
(4)满足下列要求的A的同分异构体有 种;
①能发生银镜反应
②苯环上的一氯代物有两种结构,其中核磁共振氢谱为4组峰,且峰面积之比为6:2:1:1的为 (写结构简式)。
(5)已知: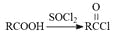 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备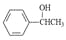 的合成路线: 。
的合成路线: 。







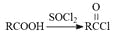 。参照上述合成路线,设计一条由苯和乙酸为起始原料制备
。参照上述合成路线,设计一条由苯和乙酸为起始原料制备 的合成路线:
的合成路线: