-
下列说法中,正确的是
A.气象环境报告中新增的“PM2.5”是对一种新分子的描述
B.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关
C.小苏打是制作面包等糕点的膨松剂,苏打是治疗胃酸过多的一种药剂
D.乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
难度: 中等查看答案及解析
-
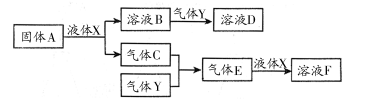
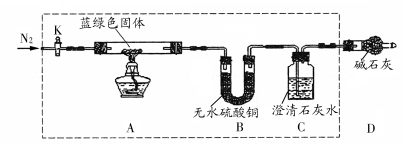
用下列装置进行相应实验,能达到实验目的的是
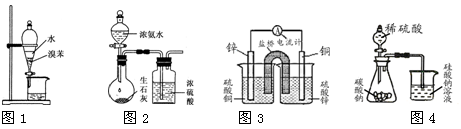
A.用图1所示装置分离出溴苯
B.用图2 所示装置制取干燥的氨气
C.用图3设计成铜锌原电池装置
D.用图4证明氢化物稳定性SiH4>CH4>H2S
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4
B.亚硫酸氢钠溶液呈酸性:HSO
+H2O
H3O++SO
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO
=Ag++NO↑+H2O
难度: 中等查看答案及解析
-
下列有关化学概念或原理的论述中,正确的是
A.任何一个氧化还原反应都可以设计为电池,输出电能
B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C.电解饱和食盐水的过程中,水的电离平衡正向移动
D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大
难度: 中等查看答案及解析
-
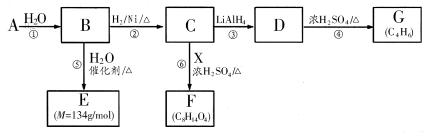
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说
法正确的是
X
Y
Z
W
A.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应
难度: 中等查看答案及解析
-
下列说法中正确的是
A.生成物总能量一定低于反应物总能量
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的
H不同
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g)
H =-38.6 kJ/mol
D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol
O2 反应放出115.6 kJ热量,键能如下表所示,则断裂1 mol
H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ
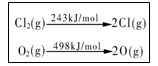
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实 验 操 作
实验现象
结 论
A
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液
均有固体析出
蛋白质均发生变性
B
将一定量的NaNO3和KCl混合液加热浓缩至有固体析出,过滤
得到白色晶体
白色晶体为KNO3
C
向某FeCl2溶液中,加入Na2O2粉末
得红褐色沉淀
原FeCl2已氧化变质
D
向浓度均为0.1 mol/L NaCl和NaI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl) > Ksp(AgI)
难度: 中等查看答案及解析