-
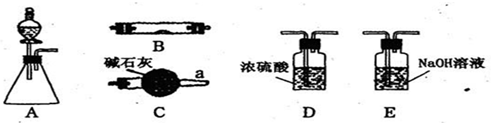
如表是元素周期表主族元素的一部分,已知短周期元素A最外层电子数是次外层的三倍.下列关于这四种元素说法正确的是( )
A B C D
A.气态氢化物的稳定性:A<D
B.原子半径:B<C<A<D
C.A与B组成的两种化合物均只由离子键构成
D.B、C、D三种元素的最高价氧化物对应水化物间可两两反应难度: 中等查看答案及解析
-
在pH=1时,可大量共存的无色溶液的一组离子或分子是( )
A.Ca2+、CH3COOH、Br-、Na+
B.NO3-、Fe3+、Mg2+、SO42-
C.ClO3-、Ba2+、Na+、Cl-
D.K+、Cl-、Al3+、SO32-难度: 中等查看答案及解析
-
下列有关实验操作的说法正确的是( )
A.从碘水中萃取碘应该用酒精作萃取剂
B.称量NaOH固体时应在托盘上各放一张大小一样的纸,在纸上称量NaOH
C.实验室制乙烯时温度计的水银球应放在烧瓶的出气口位置
D.乙醛的银镜反应实验要用水浴加热而不能用酒精灯直接加热难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol甲烷中的氢原子被氯原子完全取代,需要2NAC12
B.1L1mol/L醋酸溶液中离子总数小于2NA
C.常温下,pH=13的氢氧化钡溶液的氢氧根数目为0.1NA
D.标况时,2.24LCl2溶于足量水中转移电子数为0.1NA难度: 中等查看答案及解析
-
关于下列图示的说法中,正确的是( )
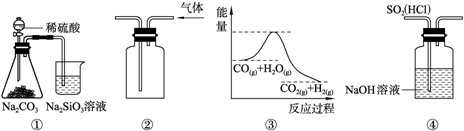
A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H大于0
D.图④装置可以用来除去SO2中的HCl难度: 中等查看答案及解析
-
某温度时,Ag2SO4在水中沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
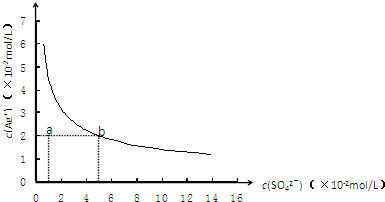
A.含有大量SO42-的溶液中肯定不存在Ag+
B.Ag2SO4的溶度积常数(Ksp)为1×10-3
C.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
D.a点可能为Ag2SO4的饱和溶液难度: 中等查看答案及解析
-
莱克多巴胺是一种可使猪“长出瘦肉”的饲料添加剂,在生猪饲养中被禁止使用,其结构如下,有关它的叙述正确的是( )

A.属于芳香烃
B.化学式为C16H23NO3
C.能发生酯化反应
D.不能发生消去反应难度: 中等查看答案及解析