-
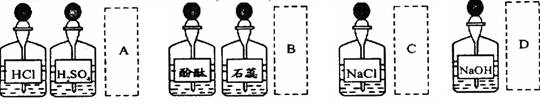
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如下图。做“硫酸的性质”的实验时,某同学取用BaCl2溶液后,应把它放回的位置是 ( )
难度: 简单查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
难度: 简单查看答案及解析
-
溶液、胶体和浊液这三种分散系的根本区别是 ( )
A.光束穿过胶体时形成一条光亮的“通路” B. 分散质粒子直径的大小
C.能否透过滤纸或半透膜 D. 是否均一、透明、稳定
难度: 简单查看答案及解析
-
某物质经分析知,其中仅含一种元素,此物质 ( )
A.可能是纯净物也可能是混合物 B.可能是单质也可能是化合物
C.一定是纯净物 D.一定是一种单质
难度: 简单查看答案及解析
-
等质量的下列物质在相同条件下体积最大的是 ( )
A.H2 B.O2 C. N2 D.CO2
难度: 简单查看答案及解析
-
有下列物质:①0.5mol NH3 ②标准状况下22.4L He ③4℃时9ml H2O ④0.2mol H3PO4。按所含的原子数由多到少的顺序排列正确的是 ( )
A.①④③② B.④③②① C.②③④① D.①②③④
难度: 简单查看答案及解析
-
对于相同物质的量的SO2和SO3,下列说法中正确的是 ( )
A.氧元素的质量比为1∶1 B.分子数之比为1∶1
C.原子总数之比为1∶1 D.质量之比为1∶1
难度: 简单查看答案及解析
-
关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子数相等,其中正确的是 ( )
A.①②③④ B.②③④ C.③④ D.③
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4LH2O含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,1 NA 个CO2分子占有的体积为22.4L
D.在1L1 mol·L-1的MgCl2溶液中,含有Cl- 个数为1 NA
难度: 简单查看答案及解析
-
在相同温度、压强下,A容器中的H2和B容器中的NH3所含氢原子数相等,则两个容器的体积比是 ( )
A.3∶2 B.1∶3 C.2∶3 D.1∶2
难度: 简单查看答案及解析
-
下列各组混合物能用分液漏斗分开的是 ( )
A.食盐、水 B.四氯化碳、水 C.乙醇、水 D.KNO3、KCl
难度: 简单查看答案及解析
-
将3.0g两种金属的混合物粉末与足量的稀盐酸反应,反应完全后,得到标准状况下的氢气2.24L。则两种金属可能是 ( )
A.Mg、Cu B.Zn、Cu C.Zn、Fe D.Mg、Al
难度: 简单查看答案及解析
-
实验中的下列操作正确的是 ( )
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入试剂瓶中
B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
C.用蒸发结晶的方法使NaCl从溶液中析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热
D.分液操作时,分液漏斗中下层液体从上口放出,上层液体从下口倒出
难度: 简单查看答案及解析
-
由阿伏加德罗常数和一个水分子的质量、一个水分子的体积,不能确定的物理量是 ( )
A.水的摩尔质量 B.1mol水蒸气的质量
C.1mol水的体积 D.1mol水蒸气的体积
难度: 简单查看答案及解析
-
某溶液中只含有Na+,Al3+,Cl-,SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为 ( )
A.1∶2 B.1∶4 C.3∶4 D.3∶2
难度: 简单查看答案及解析
-
对于某些离子的检验及结论一定正确的是 ( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 简单查看答案及解析
-
在下列溶液中,c(Cl-)与150mL 1 mol·L-1AlCl3溶液中的c(Cl-)相等的是 ( )
A.150mL 3 mol·L-1的CaCl2溶液 B.75mL l.5 mol·L-1的MgCl2溶液
C.50mL l mol·L-1的FeCl2溶液 D.225mL 2 mol·L-1的NH4Cl溶液
难度: 简单查看答案及解析
-
配制100 mL 1.0 mol·L-1Na2CO3溶液,下列操作正确的是 ( )
A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C.转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
难度: 简单查看答案及解析