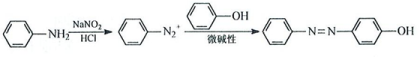
-
化学与社会、生活、生产联系广泛。下列说法正确的是( )
A.高铁酸钾处理水的原理与明矾完全相同
B.推广煤的气化和液化技术,能减少二氧化碳的排放
C.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
D.食品安全包括限制添加剂的种类和添加的量
难度: 简单查看答案及解析
-
依据下列实验现象,得出的结论正确的是 ( )
选项
操作
实验现象
结论
A
向NaBr溶液中加入氯水,再加入淀粉KI溶液
溶液变蓝
氧化性:Cl2>Br2>I2
B
将铝片放入盐酸中
产生气泡的速率开始较慢,随后加快,后来又逐渐减慢
H+的浓度是影响反应速率的唯一因素
C
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜悬浊液,加热
得到蓝色溶液
蔗糖水解产物没有还原性或蔗糖未水解
D
向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液
品红溶液褪色
气体中含有Cl2
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列叙述正确的是( )
A.1molFeI2与足量的氯气反应转移电子数为2NA
B.标准状况下22.4L一氯甲烷和二氯甲烷的混合物中所含氯原子数介于NA至2NA之间
C.0.1molCu与足量热的浓硫酸反应生成的SO2体积标准状况下约为2.24L
D.0.2mol/L的Na2S溶液中,所含S2-数目小于0.2NA
难度: 中等查看答案及解析
-
下列实验所对应的离子方程式正确的是( )
A.向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O=CaSO3↓+ 2HClO
B.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO+2OH-=BaCO3↓+CO+2H2O
D.向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+=SO42-+3S↓+2H2O
难度: 中等查看答案及解析
-
甲苯苯环上的一个H原子被-C3H6Cl取代,形成的同分异构体有(不考虑立体异构) ( )
A.9种 B.12种 C.15种 D.18种
难度: 困难查看答案及解析
-
青铜器的制造是中华民族劳动人民智慧的结晶,成为一个时代的象征,但出土的青铜器大多受到环境腐蚀。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。环境中的 Cl- 扩散到孔口,并与各电极产物作用生成多孔粉状锈 Cu2(OH)3Cl 。
下列说法不正确的是( )

A. 腐蚀过程中,负极 a被氧化
B. 环境中的Cl-扩散到孔口,并与正极反应产物和负极
反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
C. 若生成 2.145gCu2(OH)3Cl,则理论上消耗标准状况氧气体积为 0.448L
D. 正极的电极反应式为: 正极反应是 O2+ 4e-+2H2O=4OH-
难度: 极难查看答案及解析
-
已知25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式
CH3COOH
HCN
H2S
电离常数
1.8×10-5
4.9×10-10
K1=9.1×10-8
K2=1.1×10-12
25 ℃时,下列说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(Na2S)>pH(NaCN) >pH(NaHS)>pH(CH3COONa)
B.用0.1mol/L的NaOH溶液滴定pH值相等的CH3COOH和HCN溶液,CH3COOH消耗的NaOH溶液体积更大
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S)
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-d mol/L
难度: 困难查看答案及解析
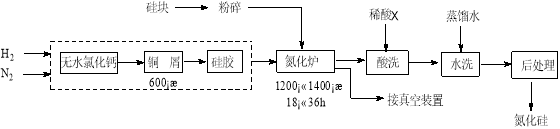


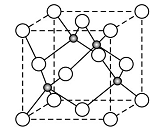

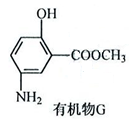 ②
②