-
化学与环境保护、社会可持续发展密切相关,下列做法合理的是 ( )
①将地沟油回收加工为生物菜油,提高资源的利用率
②进口国外电子垃圾,回收其中的贵重金属
③大量生产超薄塑料袋,方便人们的日常生活
④燃煤进行脱硫脱硝处理,减少硫的氧化物和氮的氧化物的排放
⑤洗衣粉中添加三聚磷酸钠(Na3P5O10),增强去污效果
A.②③④⑤ B.①②③ C.①②⑤ D.①④
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是 ( )
A.中子数为21的钾原子:
B.氢化钡的电子式:Ba2+
C.N2—的结构示意图:
D.聚2—甲基—1,3—丁二烯的结构简式:

难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是 ( )
A.NH3溶于水后显碱性,在FeC13饱和溶液中通入足量NH2可制取Fe(OH)2胶体
B.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
C.次氯酸钠具有强还原性,可用于配制“84”消毒液
D.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.pH=1的溶液:Na+,NH4+、S2—、NO3—
B.c(HSO2)=0.1mol/L的溶液:K+、Ba2+、HCO—、C1—
C.滴入少量苯酸显紫色的溶液:Na+、K+、I—、SO42—
D.能溶解碳酚钙的溶液:Na+、NH4+、C1—、Br—
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的,X和Z原子序数之和与Q的相等。下列说法正确的是 ( )
A.气态氢化物的稳定性:X>Y>Q
B.X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同
C.Q的单质不存在同素异形体
D.相同质量的Z和W单质分别与足量稀盐酸反应时,Z的单质获得的氢气多
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式,其中正确的是 ( )
A.向NaA1O2溶液中通入足量的CO2:A1O2+CO2+2H2O A1(OH)3↓+HCO2—
B.(NH3)2+Fe(SO3)2溶液中加入过量的氢氧化钡溶液:2NH4++Fe2++4OH— Fe(OH)2↓+2NH2·H2O
C.NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH—+H++SO42— NaSO4↓+H2O
通电
D.用惰性电极电解NaHS溶液:S2—+2H2O S↓+H2↑+2OH—
难度: 中等查看答案及解析
-
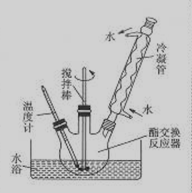
下列有关实验原理或操作正确的是 ( )
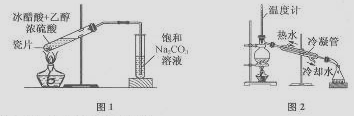
A.用10mL量筒量取5.45mL氢氧化钠溶液
B.用标准盐酸溶液滴定未知浓度的氨水用甲基橙作指示剂
C.用图1装置制取少量乙酸乙酯
D.用图2装置分离苯和溴笨
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.pH=13的氢氧化钠溶液,含Na+数目为0.1NA
B.标准状况下,22.4L乙醇中含C—H键数目为5NA
C.常温下,14g乙烯与2—丁烯的混合气体,含C—H键数目为2NA
D.反应:4Mg+10HNO3(极稀) 4Mg(NO3)2+N2O↑+5H2O,每生成1molN2O,转移电子总数为10NA
难度: 中等查看答案及解析
-
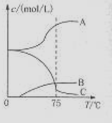
用惰性电极电解MnO4溶液可得到MnO2,MnO2的一些性质或用途如右图,下列说法正确的是( )

A.实验室用MnO2与浓盐酸制氯气时,先将MnO2加热至高温再滴入浓盐酸
B.铝置换二氧化锰中锰的反应为吸热反应
C.用石墨电极电解MnSO4溶液,在阳极得到MnO2
D.上述反应中二氧化锰均是氧化剂
难度: 中等查看答案及解析
-
下列图示与对应的叙述一定正确的是 ( )
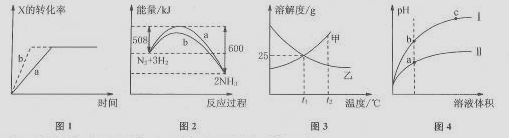
A.图1所示,反应:X(g)+2Y(g)
3Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3所示,t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液的溶质的质量分数仍然相等
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示醋酸,II表示盐酸,且溶液导电性:c>b>a
难度: 中等查看答案及解析
-
尿黑酸症是由酪氨酸在人体内非正常代谢而产生的种遗传病。其转化过程如下:
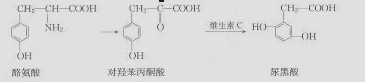
下列说法不正确的是 ( )
A.酪氨酸既能与盐酸反应又能与NaOH溶液反应
B.对羟苯酮酸分子中有3种含氧官能团
C.1mol尿黑酸最多可与含3molNaOH的溶液反应
D.可用溴水鉴别对羟苯丙酮酸与尿黑酸
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.反应:2CO(g)+2NO(g) N2(g)+2CO2(g)在温度为298K时能自发进行,则它的△H>0, △S>0
B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小
C.铅蓄电池放电时,正极和负极均有硫酸铅生成
D.反应:2A(g)
B(g)+2C(g),增大压强反应速率加快,A的转化率减小
难度: 中等查看答案及解析
-
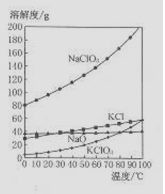
下列有关实验原理,方法和结论都正确的是 ( )
A.某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀,该钠盐一定是硫酸钠
B.在硫酸钡中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明K10(H2SO4)>K10(BaCO3)
C.新制氯水中加入碳酸钙粉末搅拌,过滤、滤液中c(HC1O)将增大
D.相同质量的两份锌粒分别加入足量稀硫酸,在一份中加入少量CuSO4·5H2O,其反应速率将加快,且最终产生的H2与另一份相同
难度: 中等查看答案及解析
-
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.弱酸性NaHSO3溶液:c(HSO2—)>c(Na+)>c(H+)>c(OH—)
B.0.1mol/LNH4HS溶液HSO3溶液:c(NH4—)<c(HS—)+c(H2S)+c(S2—)
C.0.2 mol/LNH3·H2O溶液与0.1mol/L盐酸等体积混合:c(NH4+)>c(C1—)>c(OH—)>c(H+)
D.0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:(H+)=c(OH—)+c(HCO3)+2c(H2CO3)
难度: 中等查看答案及解析
-
正丁醛可在羰基钴催化下由丙烯氢甲酰化获得:CH3CH=CH2+CO+H2
CH3CH2CH2CHO(正丁醛)副反应:CH3CH=CH2+CO+H2
(CH3)2CHCHO(异丁醛),温度对丙烯氢甲酰化产物中正/异醛比的影响如下图:

下列说法正确的是 ( )
A.丙烯氢甲酰化反应是放热反应
B.丙烯与CO4H2混合催化时,可能有丙烷及正丁醇等副产物生成
C.相同物质的量的丙烯合成正丁醛时,温度越高,所获得的正丁醛的产量一定越大
D.温度不变时,只改变体系的压强,对产率没有影响
难度: 中等查看答案及解析
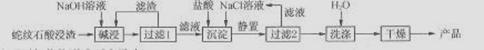

 )的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:CH3CH2OH
)的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:CH3CH2OH