-
分类是化学研究中常用的方法。下列分类方法中,不正确的是( )
A. 依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B. 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C. 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液
D. 依据组成元素的种类,将纯净物分为单质和化合物
难度: 简单查看答案及解析
-
如图标出了各种材料强度与密度的比值以及广泛使用的年代。从图中可以看出的信息有
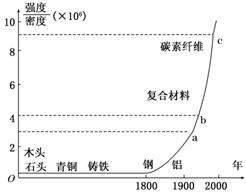
A.科学技术的发展越来越快,新材料频频出现
B.新材料发展的总体趋势是强度越来越大
C.1800年以前出现的材料强度都比铝小
D.铝的密度比钢的密度大
难度: 简单查看答案及解析
-
氧化还原反应在生产、生活中广泛存在,下列生产、生活中的实例不涉及氧化还原反应的是
A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐
难度: 简单查看答案及解析
-
下列说法正确的是
A.电解质是指在任何条件下均能导电的化合物
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在液态和水溶液里均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
难度: 简单查看答案及解析
-
科学家指出:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,它对人体是无毒的,吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:“大量海鲜+大量维生素C == 砒霜(As2O3)”。下面有关解释不正确的应该是
A.维生素C具有还原性 B.青菜中含有维生素C
C.维生素C能将+5价砷还原成As2O3 D.砒霜中毒后可服用维生素C解毒
难度: 简单查看答案及解析
-
如图所示的实验操作中正确的是
A.氢氧化钠放在纸片上称量 B.向试管中加固体粉末
C.点燃酒精灯 D.加热试管中的液体
难度: 简单查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4L H2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为NA
难度: 简单查看答案及解析
-
与9.6 g SO2所含的氧原子数相等的NO2的质量为
A.9.6 g B.6.9 g C.4.6 g D.2.3 g
难度: 简单查看答案及解析
-
某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热至熔化,发现熔化的铝并不滴落,而是好像有一层膜兜着。对该现象的说法错误的是
A.兜着液体的这层膜是氧化铝
B.该实验说明了氧化铝的熔点高于铝的熔点
C.铝极易与空气中的氧气反应在表面形成氧化物保护膜
D.铝的化学性质较稳定,即使加热到熔化也不与空气中的氧气反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.绿色食品是不含任何化学物质的食品
B.灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素
C.向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀
D.称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液,则放出氢气的体积(同温同压下)不相等
难度: 简单查看答案及解析
-
已知反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O下列说法正确的是
A.NaCl是氧化产物,NaClO3是还原产物 B.该反应中的电子转移数目为6e-
C.氧化剂和还原剂的质量比是1:5 D.Cl2既是氧化剂也是还原剂
难度: 简单查看答案及解析
-
在下列各组溶液中,离子一定能大量共存的是
A.强碱性溶液中:Na+、K+、SO42-、AlO2-
B.含有0.1 mol·L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN-
C.无色透明溶液中:HCO3-、Na+、Cl-、OH-
D.与铝反应生成H2的溶液中:Na+、Cu2+、Cl-、SO42-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.金属钠和水的反应:Na+2H2O = H2↑+Na++OH-
C.Al(OH) 3沉淀中滴加盐酸 :Al(OH) 3+3H+ = Al3++3H2O
D.AlCl3溶液中加入过量氨水:Al3++4OH-=
+2H2O
难度: 简单查看答案及解析
-
下列反应中,电子转移方向和数目正确的是( )

难度: 简单查看答案及解析
-
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,其中Na2SO3被氧化为Na2SO4 。在以上反应中,NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
难度: 简单查看答案及解析
-
有关纯碱和小苏打的叙述正确的是
A.等质量的Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多
B.等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,NaHCO3消耗的盐酸体积多
C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而向Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应
难度: 简单查看答案及解析
-
200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为
A.5.8 B.11.6 C.23.2 D.46.4
难度: 简单查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中可能含有的阳离子是 ( )
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 简单查看答案及解析
