-
化学在工农业生产和日常生活中都有着重要的应用。下列说法错误的是( )
A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
B.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
C.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
D.防止酸雨发生的重要措施之一是使用清洁能源
难度: 简单查看答案及解析
-
化学与环境、材料、信息、能源关系密切,下列说法正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.PM2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体
C.开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题
D.己知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol-1、2C(s)+O2(g)=2CO(g)△H=bkJ•mol-1,则a>b
难度: 简单查看答案及解析
-
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:

下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—= CO32—+2H2O

D.上图中△H1=△H2+△H3
难度: 中等查看答案及解析
-
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ·mol﹣1,下列说法中正确的是( )
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于0
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
难度: 中等查看答案及解析
-
化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不
可
行的是( )
选项
化学反应
测量依据(单位时间内)
A
2NO2
N2O4
颜色深浅
B
Zn+H2SO4=ZnSO4+H2
H2体积
C
CO(g)+H2O(g)=CO2(g)+H2(g)
压强变化
D
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
沉淀质量
难度: 中等查看答案及解析
-
常温下,0.1mol•L-1某一元酸(HA)溶液
中= 1×10-8,相同物质的量浓度的某一元碱(BO
H)溶液中
= 1×1012,下列叙述正确的是( )
A.PH=a的HA溶液,稀释10倍,其pH=a+1
B.等体积的HA和BOH恰好完全反应,溶液的pH=7
C.HA的pH=3;BOH的pH=13
D.相同体积相同pH的HA和盐酸分别与足量Zn反应,生成氢气的物质的量相同
难度: 中等查看答案及解析
-
某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g)
CH3OH(g) △H1=-90.7 kJ•mol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:( )
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(L·min)
C.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4
D.其它条件不变的情况下,加入催化剂可提高CO的转化率
难度: 中等查看答案及解析
-
LED系列产品是被看好的一类节能新产品,如图是一种氢氧燃料电池驱动LED发光的装置.下列有关叙述正确的是( )
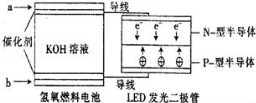
A.a处通入氢气,发生了还原反应:H2﹣2e﹣+2OH﹣=2H2O
B.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
C.b处通入氧气,为电池的正极
D.P﹣型半导体连接的是电池负极
难度: 困难查看答案及解析
-
实验室用标准 KMnO4 溶液滴定未知浓度的 FeSO4,下列说法或操作正确的是( )
A.盛 FeSO4溶液的锥形瓶滴定前用 FeSO4溶液润洗 2—3 次
B.选碱式滴定管盛放标
准 KMnO4溶液,并用碘化钾淀粉溶液作指示剂
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.滴定前仰视读数,滴定后俯视读数会导致滴定
结果偏低
难度: 中等查看答案及解析
-
有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若
甲不变,将乙蒸发掉一半水(溶质不析出),丙中通入一定量的CO2。然后以酚酞作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是( )
A.V甲=V乙>V丙 B.V丙>V乙>V甲 C.V乙>V丙>V甲 D.V甲=V乙=V丙
难度: 中等查看答案及解析
-
在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+C
O2(g)
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
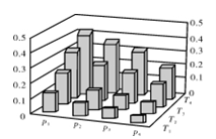
A.P1>P2>P3>P4
B.若T1> T2> T3>T4,则该反应为放热反应
C.甲醇的物质的量分数越高,反应的平衡常数越大
D.缩小容积,可以提高CH3OH在混合物中的质量分数
难度: 困难查看答案及解析
-
在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3②Na2CO3③KCl④CuCl2⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )
A.①②③ B.①③⑤ C.②④ D.①③④⑤
难度: 中等查看答案及解析
-
25℃时,在10 mL浓度均为0.1 mol/LNaOH和NH3·H2O混合溶液中滴加0.1 mol/L盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(
OH-)>c(Na+)=c(NH3·H2O)
B.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
C.加入10 mL盐酸时:c(NH
)+c(H+)=c(OH-)
D.加入20 mL盐酸时:c(Cl-)=c(NH
)+c(Na+)
难度: 中等查看答案及解析
-
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g),反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2,Y的百分含量与时间的关系如图2所示。下列分析不正确的是( )
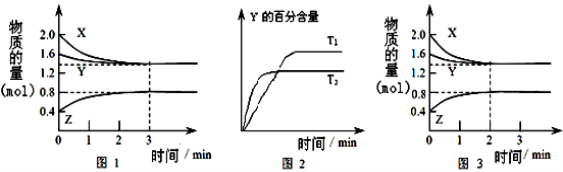
A.容器中发生的反应可表示为:3X(g)+Y(g)⇌2Z(g)
B. 0~3min内,v(X)=0.1 mol/(L•min)
C.若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强
D.达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正>v逆
难度: 困难查看答案及解析
-
某Na2CO3、NaAlO2的混合溶液中逐滴加入1 mol/L的盐酸,测得溶液中CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )
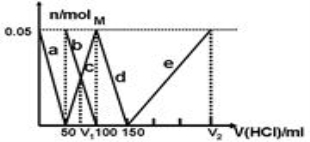
A.a曲线表示的离子方程式为AlO2-+H++H2O==Al(OH)3↓
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
C.V1∶V2=l∶5
D.M点时生成的CO2为0.05 mol
难度: 困难查看答案及解析
-
在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是( )

难度: 困难查看答案及解析
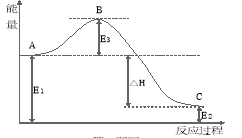

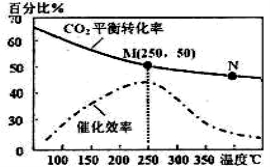
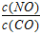 =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。