-
关于吸热反应的说法正确的是( )
A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应
C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应
难度: 简单查看答案及解析
-
下列不属于自发进行的变化的是( )
A.红墨水加到蒸馏水中使整杯水变红 B.冰在室温下融化成水
C.NaHCO3受热转化为Na2CO3 D.铁在潮湿的空气中生锈
难度: 简单查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是( )
A、氨水应放置低温处密闭保存 B、由H2、I2(g)、HI组成的平衡体系,加压后颜色加深
C、光照新制氯水,黄绿色逐渐变浅 D、开启可乐瓶后,瓶中马上泛起大量泡沫
难度: 简单查看答案及解析
-
在密闭容器中发生如下反应:mA(g)+nB(g)
pC(g),达到平衡后,保持温度不变,将气体体积压缩到原来的1/3,当达到新平衡时,C的浓度变为原来2倍,下列说法错误的是( )
A.m+n<p B.平衡向逆反应方向移动
C.A的转化率降低 D.C的体积分数增大
难度: 简单查看答案及解析
-
下列离子组在由水电离出的c(OH-)=1×10-13mol/L的溶液中一定能大量共存的是( )
A.Ba2+、Mg2+、SO42-、Cl- B.Na+、K+、Cl-、SO42-
C.HCO3-、Na+、Al3+、K+ D.I-、NH4+、Na+、NO3-
难度: 简单查看答案及解析
-
反应CH3OH ( l )+ NH3( g ) = CH3NH2( g ) + H2O ( g )在某温度自发向右进行,若反应|ΔH|= 17kJ/mol,|ΔH—TΔS|= 17kJ/mol,对于该反应下列关系正确的是( )
A. ΔH >0,ΔH–TΔS<0 B. ΔH <0,ΔH–TΔS>0
C. ΔH >0,ΔH–TΔS>0 D. ΔH <0,ΔH–TΔS<0
难度: 简单查看答案及解析
-
对于可逆反应A2+3B2
2AB3,下列各项所表示的反应速率中,反应最快的是( )A、VA2=0.4mol / L·min B、VB2=0.8 mol / L·min
C、VAB3=0.6 mol / L·min D、VA2=0.01mol / L·S
难度: 简单查看答案及解析
-
在一定温度下,可逆反应A(g)+3B(g)
2C(g) 在体积不变的密闭容器中进行,下列各项描述中,能说明其已到达平衡状态的是( )
①C的生成速率与C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④混合气体的总压强不再变化;⑤混合气体密度不发生变化;⑥混合气体的平均摩尔质量不发生变化;
A、全部 B、只①③④ C、只①③④⑥ D、只②⑤
难度: 简单查看答案及解析
-
常温时,等体积等物质的量浓度的下列物质的溶液中①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3,水的电离程度由大到小顺序排列的是( )
A.①>②>③>④ B.①>④>③>② C.②>①>③>④ D.②>③>④>①
难度: 简单查看答案及解析
-
常温时,下列溶液的pH等于8或大于8的是( )
A.0.1 mol/L的NaOH溶液滴定锥形瓶中的稀盐酸,用酚酞做指示剂滴定到终点
B.pH=6的醋酸用水稀释100倍
C.pH=10的氢氧化钠溶液稀释1000倍
D.0.1 mol/L的硫酸100 mL与0.1 mol/L NaOH溶液150 mL充分反应
难度: 简单查看答案及解析
-
在蒸发皿中加热蒸干下列物质的溶液,并在空气中灼烧,可以得到该物质的固体的是( )
A.氯化铁 B.亚硫酸钠 C. 碳酸氢铵 D.偏铝酸钠
难度: 简单查看答案及解析
-
下列事实能说明亚硝酸是弱电解质的是( )
A.0.1mol/L亚硝酸溶液使pH试纸变红 B.用亚硝酸溶液做导电试验,灯泡很暗
C.亚硝酸溶液不与硫酸钠溶液反应 D.常温下亚硝酸钠溶液的pH大于7
难度: 简单查看答案及解析
-
在0.1 mol/L的NaAc(醋酸钠)溶液中,欲使c(Na+)/c(Ac-)比值减小,可采取的措施是( )
A. 加热 B. 加少量水 C. 加少量盐酸 D. 加少量醋酸钠晶体
难度: 简单查看答案及解析
-
碳酸(H2CO3)是二元弱酸,碳酸氢钾溶液呈碱性。在0.1mol/LKHCO3溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) B.c(HCO3-)+c(CO32-)=0.1 mol/L
C.c(CO32-)>c(H2CO3) D.c(K+)+ c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
难度: 简单查看答案及解析
-
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
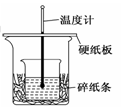
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高。
难度: 简单查看答案及解析
-
已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是( )
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20ml 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
难度: 简单查看答案及解析
