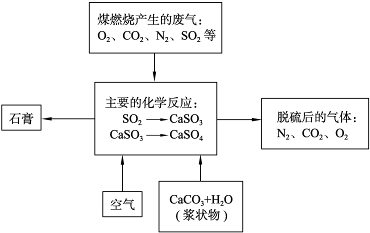
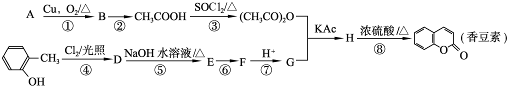-
下列关于C、Si、S、Cl四种非金属元素的说法中,正确的是( )
A.两两结合形成的化合物都是共价化合物
B.在自然界中都能以游离态存在
C.氢化物的热稳定性比较:CH4<SiH4<H2S<HCl
D.最高价氧化物都能与水反应生成相应的酸,且酸性依次增强难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.有机化合物中每个碳原子最多形成4个共价键
B.油脂、淀粉、蛋白质在一定条件下都能发生水解反应
C.用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯
D.乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键难度: 中等查看答案及解析
-
化学与生产、生活密切相关.下列叙述中,不正确的是( )
A.航天飞机上的隔热陶瓷瓦属于复合材料
B.明矾净水的原理和“84”消毒液消毒的原理相同
C.食醋可去除水垢,NH4Cl溶液可去除铁锈
D.SO2和NO2都能使雨水的pH<5.6,造成酸雨难度: 中等查看答案及解析
-
氧元素是地壳中含量最多的元素.下列说法中,正确的是( )
A.16O2与18O3互为同位素
B.氧元素与其他短周期非金属元素均能形成酸性氧化物
C.氧与钠形成的稳定化合物中,阴、阳离子个数比均为1:2
D.O2变成O3以及16O变成18O的变化均属于化学变化难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.1.00L 1.00 mol•L-1盐酸中含有6.02×1023个HCl分子
B.1.00L 1.00 mol•L-1 Na2CO3溶液中,CO2-3所带电荷总数为2×6.02×1023
C.78.0g Na2O2与水完全反应,产生11.2L氧气(标准状况)、转移6.02×1023个电子
D.配制1.00L 1.00 mol•L-1的CuSO4溶液,可将250.0 g CuSO4•5H2O溶于1.00 L水中难度: 中等查看答案及解析
-
下列有关实验操作、发生的现象、解释或结论都正确的是( )
选项 实验操作 发生现象 解释或结论 A 向NaCl和KI的混合溶液中,逐滴加入AgNO3溶液 溶液中先产生白色沉淀,后产生黄色沉淀 Ksp(AgCl)<Ksp(AgI) B 用玻璃棒蘸取氯水点到蓝色石蕊试纸上 试纸先变红后褪色 氯水中含有H+和HClO C 将铜片与芯片用导线连接后,插入稀硫酸中 铜片上有气泡产生 在锌的作用下,铜与硫酸反应产生氢气 D 向某溶液中加入过量盐酸 产生能使澄清石灰水变浑浊的无色气体 该溶液为Na2CO3
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
有关下列两种溶液的说法中,正确的是( )
溶液①:0.2mo1•L-1 CH3COONa溶液;
溶液②:0.1mo1•L-1H2SO4溶液.
A.相同温度下,溶液中水的电离程度:溶液①<溶液②
B.加水稀释溶液①,溶液中变大
C.等体积混合溶液①和溶液②,所得溶液中c(CH3COO-)+2c(SO42-)=c(Na+)
D.25℃时,向溶液②中滴加溶液①至pH=7,溶液中c(Na+)>c(SO42-)难度: 中等查看答案及解析