-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象
解释
A
用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色
该溶液中一定含有Na+,一定无K+
B
SO2能使酸性高锰酸钾溶液褪色
SO2具有漂白性
C
某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42﹣
D
铁加入稀硝酸中有气泡产生
铁与稀硝酸发生了置换反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列叙述中正确的是
A. 含金属元素的离子,不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原一定得到金属单质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 标准状况下,11.2LCH2C12含极性共价键数目为2NA
B. 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目大于NA
C. 4.6g甲苯(C7H8)和丙三醇(C3H8O3)混合物中含H原子数目为0.4NA
D. 将1molCl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
难度: 中等查看答案及解析
-
最近我国科学家研究发现人体中微量的H2S能有效预防心脏病、老年性痴呆症。下列有关H2S的说法正确的是
A.H2S属于非电解质 B.人体内H2S可由含硫蛋白质降解产生
C.大量吸入H2S对人体无害 D.H2S只有还原性没有氧化性
难度: 中等查看答案及解析
-
下列说法正确的是
A.H2、D2、T2属于同位素
B.氯水、氨水、王水是混合物,水银、水玻璃是纯净物
C.水能、风能、生物质能是可再生能源,煤、石油是不可再生能源
D.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH不是电解质
难度: 中等查看答案及解析
-
实验室欲配制100mL l.0mol/L Na2CO3溶液,下列操作正确的是( )
A. 用托盘天平称量Na2CO3•10H2O晶体10.6g,倒入烧杯中加适量的水溶解
B. 当烧杯中固体全部溶解后,立即用玻璃棒引流转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 若配制时,俯视液面定容,所配溶液的浓度偏高,再补加少量蒸馏水至刻度线
难度: 简单查看答案及解析
-
下列物质可通过化合反应直接制得到的是( )
①Cu(OH)2 ②Ba(OH)2 ③H2SiO3 ④H2SO4
A. ①② B. ③④ C. ②④ D. ②③
难度: 简单查看答案及解析
-
下列电离方程式中,正确的是
A. Na2SO4=2Na++S04-2 B. Ba(OH)2=Ba2++OH-2
C. Al2(SO4)3=2A13++3SO42- D. Ca(N03)2=Ca2++2(N03) 2-
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )
A.KNO3是还原剂,其中N元素被氧化
B.生成物中的N2是氧化产物,K2O是还原产物
C.当氧化产物比还原产物多2.8g时,转移电子1/14 mol
D.氧化剂与还原剂的物质的量之比5:1
难度: 简单查看答案及解析
-
含有MgCl2、NaCl、Na2SO4三种物质的混合溶液,其中含有Cl-为1.8mol,Na+为2mol,Mg2+为0.5mol,则SO42-的物质的量为( )
A. 0.6mol B. 0.7mol C. 1.2mol D. 1.0mol
难度: 中等查看答案及解析
-
下列对于过氧化钠的叙述中,正确的是( )
A. 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B. 1 mol Na2O2与H2O完全反应,转移2 mol电子
C. 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D. a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
难度: 中等查看答案及解析
-
将标准状况下的V L HCl(气)溶于1000 g水中,得到的盐酸密度为ρ g·cm-3,则该盐酸的物质的量浓度为
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 困难查看答案及解析
-
下列溶液中,能大量共存的离子组是
A. 遇酚酞试剂变红的溶液:K+、Cu2+、NO3-、SO42-
B. 遇紫色石蕊试剂变红的溶液:K+、Na+、Cl-、CO32-
C. 常温下pH<7的溶液:Ba2+、NH4+、NO3-、Cl-
D. 无色透明溶液中:K+、Na+、MnO4-、SO42-
难度: 中等查看答案及解析
-
氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
A. 分散质粒子直径在1~100nm之间
B. 能透过半透膜
C. 都是透明的
D. 呈红褐色
难度: 简单查看答案及解析
-
某学生配制100mL 1mol/L的硫酸溶液,进行下列操作,然后对溶液浓度作精确测定,发现真实浓度小于1mol/L。他的下列操作中使浓度偏低的原因是 ( )
①用量筒取浓硫酸时,俯视读数;②量筒中浓硫酸全部转移到烧杯中稀释,再转移到100mL容量瓶中,烧杯未洗涤;③用玻璃棒引流将烧杯中溶液转移至容量瓶中,有溶液流到了容量瓶外面;④用胶头滴管加蒸馏水时,不是逐滴加入,因而使液面超过了刻度线,他立即用滴管吸去多余的水,使溶液凹面刚好和刻度线相切。
A. ②③④ B. ③④
C. ①②③ D. ①②③④
难度: 中等查看答案及解析
-
实验是研究化学的基础,下列图中所示的实验操作中正确的是( )
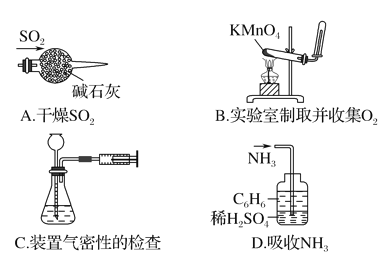
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关氧化还原反应的说法正确的是
A.化合价升高的物质发生氧化反应,被还原,作还原剂
B.化合价降低的物质发生还原反应,被还原,作氧化剂
C.失电子的物质发生还原反应,被氧化,作还原剂
D.得电子的物质发生还原反应,被氧化,作氧化剂
难度: 中等查看答案及解析
-
绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列用氨气氮肥的制备反应中,原子利用率最高的是
A.NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl
B.2NH3+CO2=2H2O+CO(NH2)2
C.8NH3+3Cl2=N2+6NH4Cl
D.NH3+HCl=NH4Cl
难度: 中等查看答案及解析
-
常温下,在溶液中发生如下反应:①16H++10Z-+2XO===2X2++5Z2+8H2O
②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z-,则下列反应中能进行的是
A. A3++Z-―→Z2+A2+ B. A3++X2++H2O―→A2++XO+H+
C. XO+A2++H+―→X2++A3++H2O D. B2+X2++OH-―→B-+XO+H2O
难度: 中等查看答案及解析
-
下列操作过程中一定有氧化还原反应发生的是( )
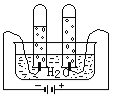
A. B. C. D.
难度: 简单查看答案及解析