-
下列说法正确的是
A.利用高纯度二氧化硅制造的太阳能电池板可将光能直接转化为电能
B.硝化甘油、火棉、TNT均是硝酸酯化反应以后的产物
C.煤中加入生石灰、汽车中加装尾气处理装置、利用二氧化碳制造全降解塑料都能有效减少环境污染
D.红外光谱法、紫外光谱法、核磁共振、同位素示踪法等都是现代化学测定有机物结构的常用方法
难度: 简单查看答案及解析
-
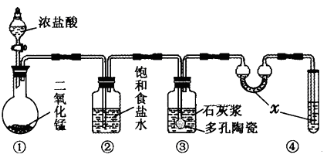
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb 和PbO2,电解液是H2SO4溶液。现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.蓄电池放电时,电路中每转移2 mol电子,最多有1 molPbO2被还原
B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后,c(Na2SO4)不变,且溶液中有晶体析出
D.蓄电池中每生成1mol H2O,电解池中就消耗1mol H2O
难度: 中等查看答案及解析
-
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
A.滴加KI溶液时,KI被氧化,CuI是还原产物
B.通入SO2后,溶液变无色,体现SO2的还原性
C.整个过程发生了复分解反应和氧化还原反应
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 中等查看答案及解析
-
课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是
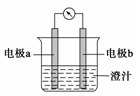
A.原电池是将化学能转化成电能的装置
B.原电池由电极、电解质溶液和导线等组成
C.图中a极为铝条、b极为锌片时,导线中会产生电流
D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片
难度: 中等查看答案及解析
-
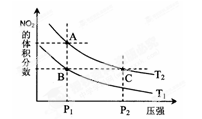
下列叙述正确的是
A.标准状况下,1.12 L16O2和1.12 L18O2均含有0.1NA个氧原子
B.第三周期非金属元素含氧酸的酸性从左到右依次增强
C.能使甲基橙显红色的溶液中大量存在:Mg2+、Fe2+、Cl—、NO3-
D.从C(石墨)===C(金刚石);ΔH=+1.9 kJ·mol-1,可知金刚石比石墨更稳定
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4…
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4-…
Cl2、Mn2+…
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
难度: 困难查看答案及解析
-
关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH4+):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析