-
“海上风电,如东是真正的全国领先”。下列有关说法正确的是

①风能其实是太阳能的一种转换形式
②风能和水能、太阳能等都是可再生能源
③风力发电由风能转换为机械能,再转化为电能
④在未来多能源时期,氢能、生物质能等的核心仍是化学反应
A.①②③④ B.②③④ C.①②③ D.①②④
难度: 简单查看答案及解析
-
下列关于化学用语的表示正确的是
A.质子数为17、中子数为20的氯(Cl)原子:2017Cl
B.CO2的电子式:
C.镁离子的结构示意图:
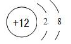
D.CCl4分子的比例模型:
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液中:NH4+、Mg2+、SO42-、NO3-
B.1.0 mol•L-1FeCl3溶液中:Na+、Cl-、NO3-、SCN-
C.1.0 mol•L-1KNO3溶液中:Fe2+、H+、Cl-、SO42-
D.与Al反应能放出H2的溶液中:Na+、Cl-、HCO3-、SO42-
难度: 困难查看答案及解析
-
下列装置能达到实验目的的是

A.用装置甲蒸发、结晶制取粗盐 B.用装置乙加热熔融NaOH固体
C.用装置丙除去CO2中的少量HCl D.用装置丁进行萃取、分液
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、M、N的原子序数依次增大。X和M的原子核外均有两个未成对电子,但不处于同一主族,Y、Z、M最高价氧化物对应的水化物两两之间能相互反应,N和M相邻。下列叙述正确的是
A.原子最外层电子数由少到多的顺序:Y、Z、X、M、N
B.单质Y的熔点高于单质Z的熔点
C.元素非金属性由弱到强的顺序:M、N、X
D.电解N和Y、Z形成的化合物可分别得到对应的Y和Z
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.H2、SO2、CO2三种还原性气体都可用浓硫酸干燥
B.二氧化硫能使溴水褪色,说明二氧化硫具有漂白性
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+、无K+
D.向Na2O2与水完全反应后的溶液咖MnO2,产生氧气,是由于该溶液中含有H2O2
难度: 中等查看答案及解析
-
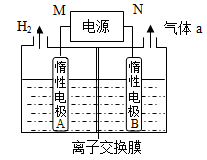
下列指定反应的离子方程式正确的是
A.硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O
C.惰性电极电解MgCl2溶液:2Cl-+2H2O
H2↑+Cl2↑+2OH-
D.次氯酸钙溶液中通入少量的二氧化碳:2ClO-+CO2+H2O=CO32-+2HClO
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2 L乙醇中含有分子的数目为0.5NA
B.电解精炼铜的过程中转移了NA个电子,则阴极析出32 g铜
C.2.8 g由氮气和一氧化碳组成的混合气体中含有原子的数目为0.1NA
D.加热条件下,20mL 10 mol/L 浓硝酸与足量铜反应转移电子数为0.1NA
难度: 困难查看答案及解析
-
一定条件下,甲组内任意一种物质和乙组内任意一种物质都能发生反应的是
甲
乙
A
H2、O2
N2、CuO
B
HCl、NaOH
Fe、Al
C
SiO2、浓H2SO4
NaOH、C
D
CO2、H2O
Na2O2、NaCl
难度: 中等查看答案及解析
-
人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是
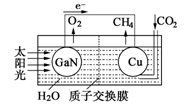
A.该装置为原电池,且铜为正极
B.电池工作时,H+向Cu电极移动
C.GaN电极表面的电极反应式为:2H2O-4e-=O2+4H+
D.反应CO2+2H2O
CH4+2O2中每消耗1molCO2转移4mole-
难度: 困难查看答案及解析
-
下列说法正确的是
A.铅蓄电池放电时负极质量减少
B.在海轮外壳连接镁合金保护外壳不受腐蚀
C.对于同一个化学反应,一步完成和分步完成其反应的焓变亦不相同
D.反应 MnO4-+H2O2+H+=Mn2++H2O+O2(未配平)中每生成1 mol O2转移2 mol e-
难度: 中等查看答案及解析
-
中国科学家屠呦呦获得2015年诺贝尔医学奖。她研究的青蒿素、双氢青蒿素在寄生虫疾病治疗方面取得了伟大成就。下列有关说法正确的是
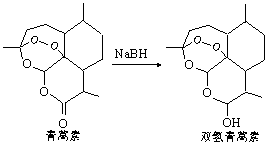
A.青蒿素的化学式为C15H20O5
B.青蒿素转化为双氢青蒿素是氧化反应
C.青蒿素、双氢青蒿素分子内各有2个七元环
D.青蒿素、双氢青蒿素分子内均含有7个手性碳原子
难度: 中等查看答案及解析
-
下列设计的实验方案能达到实验目的的是
A.通过灼热的镁粉除去N2中的O2
B.用湿润碘化钾试纸鉴别Br2(g)和NO2
C.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体
D.检验溶液中是否有SO42-:先将溶液用足量盐酸酸化,再滴加BaCl2溶液
难度: 中等查看答案及解析
-
下列图像最能反映2H2+O2
2H2O 反应过程中能量变化的是
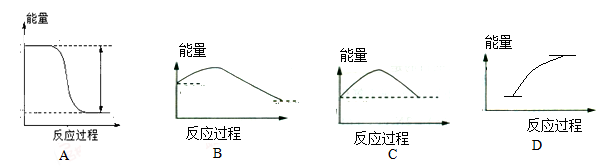
难度: 简单查看答案及解析
-
有序思维模式有利于解决复杂混合体系中的化学问题。下列反应先后顺序判断正确的是
A.在含等物质的量的CO32-、OH-的溶液中,逐滴加入稀盐酸: OH-、CO32-、HCO3-
B.在含等物质的量的Al3+、NH4+的溶液中,逐滴加入NaOH溶液: Al3+、Al(OH)3、NH4+
C.在含铁和铜的混合物中逐滴加入稀硝酸:Fe、Cu、Fe2+
D.惰性电极电解含等物质的量Zn2+、Al3+溶液时阴极电极反应:Zn2+、Al3+、H+
难度: 困难查看答案及解析