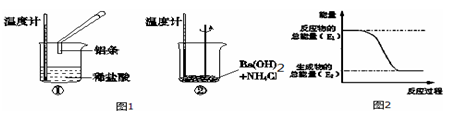
-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.14C可用于文物的年代的鉴定,12C和14C互为同位素
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物 ②第IA族和第ⅦA族原子化合时,一定生成离子键 ③由非金属元素形成的化合物一定不是离子化合物 ④活泼金属与非金属化合时,能形成离子键 ⑤离子键就是阴、阳离子间的相互引力 ⑥含有离子键的化合物一定是离子化合物 ⑦离子化合物中可能同时含有离子键和共价键
A.①②⑤ B.④⑥⑦ C.①④③ D.②③⑤
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.4℃时,18g 21H2168O中含有电子数为10NA
B.在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA
C.常温下, 1L0.1mol · L-1 的NH4NO3溶液中所含氮原子数为0.2 NA
D.标准状况下,22.4 L的CCl4中C—Cl键数为4NA
难度: 中等查看答案及解析
-
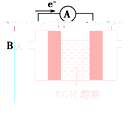
关于如右图所示的原电池,下列说法正确的是( )。
A.电流从锌电极通过电流表流向铜电极
B.锌电极发生还原反应,铜电极发生氧化反应
C.当有13 g Zn溶解时,外电路中就有0.4 mol电子通过
D.铜电极作正极,发生的电极反应为2H++2e-===H2↑
难度: 中等查看答案及解析
-
下列变化中生成物的总能量小于反应物的总能量的是( )
A.灼热的炭与CO2反应
B.H—Cl → H + Cl
C.H2SO4 + 2NaOH = Na2SO4 + 2H2O
D.C(s)+H2O(g)=CO(g)+H2(g)
难度: 简单查看答案及解析
-
下列各组给定原子序数的元素,不能形成原子个数之比为1∶1共价化合物的是( )
A.3和17 B.1和8 C.6和8 D.1和9
难度: 中等查看答案及解析
-
下列能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS。
A.①②④⑤ B.①②③⑥ C.①③⑤⑥ D.①③④⑥
难度: 中等查看答案及解析
-
两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中,满足上述关系的元素共有( )
A.1对 B.2对 C.3对 D.4对
难度: 中等查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述不正确的是( )
A.原子半径B>A>C>D B.原子序数 a >b>c> d
C.离子半径C3->D->B+>A2+ D.离子的还原性C3->D-
难度: 中等查看答案及解析
-
已知反应A2+B2===2AB,破坏1 mol A2中的化学键消耗的能量为Q1 kJ,破坏1 mol B2中的化学键消耗的能量为Q2 kJ,形成1 mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
A.若A2和B2的总能量之和大于生成的AB的总能量,则反应吸热
B.若A2和B2的总能量之和小于生成的AB的总能量,则反应放热
C.若该反应为放热反应,则Q1+Q2<2Q3
D.若该反应为吸热反应,则Q1+Q2<Q3
难度: 中等查看答案及解析
-
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
A.MgF2 B.MgCl2 C.CaCl2 D.CaBr2
难度: 中等查看答案及解析
-
实验室用100mL 1 mol·L—1盐酸与足量锌粉反应制备氢气,下列措施能加快反应速率且不影响产生氢气的量是( )
A.改用100mL2mol·L—1盐酸 B.加入碳酸钠固体 C.滴加少量CuCl2溶液 D.降低温度
难度: 中等查看答案及解析
-
根据表中八种短周期元素的有关信息判断,下列说法正确的是( )

A.元素④气态氢化物的稳定性小于元素⑤气态氢化物的稳定性
B.元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点
C.元素④⑥形成的化合物具有两性
D.元素④⑥⑧的最高价氧化物的水化物两两之间皆能反应
难度: 中等查看答案及解析
-
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )
A.X能形成化学式为H2XO4的酸
B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X可能形成化学式为KXO3的盐
难度: 中等查看答案及解析
-
在一定条件下的定容密闭容器中,下列说法能表明反应A(s) + 2B(g)
C(g) + D(g) 已达平衡状态的是( )
A.混合气体的压强不再改变
B.单位时间内生成nmolA的同时,生成2nmol的B
C.C的生成速率是B的生成速率的两倍
D.混合气体的密度不再改变
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是( )
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为
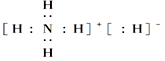
D.它与水反应的化学方程式为NH5+H2O===NH3·H2O+H2↑
难度: 中等查看答案及解析