-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
测得纳米材料Fe3O4的微粒直径为90nm
纳米材料Fe3O4属于胶体
B
C(金刚石,s)===C(石墨,s) ΔH=-1.5 kJ·mol-1
相同条件下,石墨比金刚石稳定
C
NaHCO3溶液呈碱性
NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,增大c(HCO3-)
D
反应物比例不同可导致产物不同
Na与O2反应可能生成Na2O,也可能生成Na2O2
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.过氧化钠与水反应时,生成22.4L氧气转移的电子数为2 NA
B.18g D2O中含有的电子数和中子数均为10 NA
C.密闭容器中2mol NO与1mol O2充分反应,产物的分子数为2 NA
D.1mol Na与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去 NA个电子
难度: 简单查看答案及解析
-
某分子式为C10H20O2的酯,在一定条件下可发生如下图的转化过程:则符合上述条件的酯的结构可有

A.2种 B.4种 C.6种 D.8种
难度: 简单查看答案及解析
-
如图甲池和乙池中的四个电极都是铂电极,乙池溶液分层,上层溶液为某盐溶液,呈中性。请根据下图所示,判断下列有关说法正确的是

A.甲池是电解池,乙池是原电池;A电极反应式为:C2H5OH+3H2O -12e-===2CO2+12H+
B.反应一段时间后,两池溶液的pH均未变化
C.假如乙池中加入K2SO4溶液,隔膜只允许K+通过,当电路中转移0.01mol e-时,则隔膜左侧溶液中最终减少离子约0.02mol
D.假如乙池中加入NaI溶液,则在乙池反应过程中,可以观察到C电极周围的溶液呈现棕黄色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色
难度: 困难查看答案及解析
-
MOH和ROH两种一元碱,常温下其水溶液分别加水稀释时,pH变化如下图。下列说法正确的是

A.在X点时,由H2O电离出的c(H+)相等,c(M+) = c(R+)
B.稀释前,c(ROH)=10c(MOH)
C.稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性
D.等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X与W同主族,X、W的单质在标准状况下的状态不同。Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。下列说法正确的是
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X),离子半径大小顺序:r(Z2-)>r(W+)
B.元素Y的简单气态氢化物的热稳定性和熔沸点都比Z的高
C.由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
D.化合物X2Z2与W2Z2所含化学键类型完全相同
难度: 简单查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
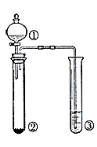
A
浓盐酸
Na2CO3
Na2SiO3溶液
非金属性:Cl > C > Si
B
稀硫酸
Na2S
AgNO3与AgCl的浊液
Ksp(AgCl)>Ksp(Ag2S)
C
浓氨水
碱石灰
AlCl3溶液
Al(OH)3是两性氢氧化物
D
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
难度: 简单查看答案及解析






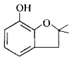 呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式:
呋喃酚是一种合成农药的重要中间体,它的同分异构体很多,写出符合下列条件的所有芳香族同分异构体的结构简式: