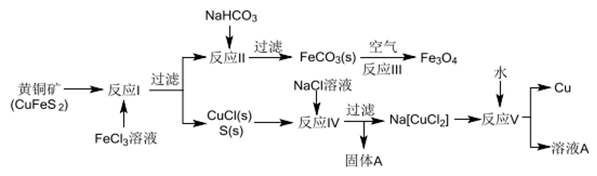
-
X、Y、Z、W、R属于短周期主族元素。X的原子半径在短周期主族元素中最大,Y核素的最外层电子数为m,次外层电子数为n, Z原子的L层电子数为m+n, M层电子数为m-n≠0 , W与Z同主族,R与Y的核外电子数之比为2:1,下列叙述错误的是( )
A. X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2
B. Y的氢化物比R的氢化物稳定,沸点高
C. Y分别与Z、W、R以两种元素组成的常见化合物有3种
D. Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A. 糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物
B. 乙醇、乙酸均能与NaOH反应.是因为分子中均含有官能团“-OH”
C. 分子式为C6H12且碳碳双键在链端的烯烃共有6种异构体
D. 分子式为C4H7ClO2的羧酸可能有5种
难度: 困难查看答案及解析
-
化学与社会、生活密切相关.下列说法不正确的是( )
A. 将“地沟油”制成肥皂,可以提高资源的利用率
B. 用Al(OH)3可以做塑料的阻燃剂,因为它受热熔化放出大量的热
C. 海底可燃冰开发不当释放出的甲烷会造成温室效应的加剧
D. 可以用钢瓶储存液氯或浓硫酸
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. l04g苯乙烯(C6H5-CH=CH2)中含有8NA的碳氢键和4NA的碳碳双键
B. 在50g质量分数为46%的乙醇水溶液中,含有氢原子数为3NA
C. lmol有机物CH3-CH=CH-CH2-CH3中最多有9NA个原子在同一平面上
D. 80℃ 时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
难度: 中等查看答案及解析
-
下列有关实验操作、现象和目的或结论的说法正确的是( )
选项
操作
目的或结论
A
将Fe(NO3)2晶体溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红
检验Fe(NO3)2样品是否已被氧化而变质
B
海带提碘实验中,为了制取海带灰的浸取液,需要煮沸海带灰和水的混合物1~2min
主要目的是去除溶液中的氧气,避免氧气氧化碘离子
C
在试管中依次加入2mL浓硫酸、3mL乙醇和2mL乙酸,用酒精灯缓慢加热
制备乙酸乙酯
D
向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分震荡,白色固体溶解
NH4+与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的
是( )
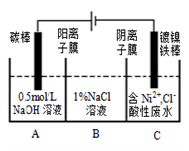
已知:放电顺序:Ni2+(高浓度)>H+> Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O
B. 为了提高Ni的产率,电解过程中需要控制废水pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断增大
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不会发生改变
难度: 中等查看答案及解析
-
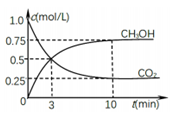
常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )
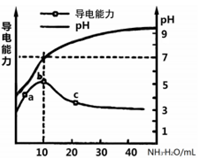
A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
难度: 困难查看答案及解析

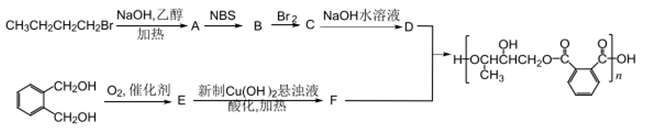
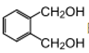 的符合下列条件的同分异构体有_____种。
的符合下列条件的同分异构体有_____种。