-
有关常温下pH均为3的醋酸和硫酸的说法正确的是
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
难度: 中等查看答案及解析
-
下列各选项中所述的两个量,前者一定大于后者的是
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数
B.pH=1的CH3COOH溶液和盐酸的物质的量浓度
C.pH=12的氨水和NaOH溶液的导电能力
D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积
难度: 中等查看答案及解析
-
已知反应X+Y===M+N为吸热反应,对这个反应的下列说法中正确的是
A.X的能量一定低于M的能量,Y的能量一定低于N的能量
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 简单查看答案及解析
-
已知:
(1) H2(g)+1/2O2(g)===H2O(g) ΔH1=a kJ/mol;
(2) 2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ/mol;
(3) H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ/mol;
(4) 2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ/mol
下列关系式中正确的是
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 简单查看答案及解析
-
如图所示是298 K时N2与H2反应过程中 ,能量变化的
曲线图.下列叙述正确的是
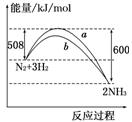
A.该反应的热化学方程式为:N2+3H2
2NH3 ΔH=-92 kJ/mol
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,
若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
难度: 简单查看答案及解析
-
往平底烧瓶中放入氢氧化钡晶体和氯化铵晶体,塞紧瓶塞。在木板上滴少量水一会儿就会发现瓶内固态物质变成液体,瓶壁变冷,小木板上因少量水冻结,而被烧瓶粘住,这时打开瓶塞,出来的气体有氨味。这是自发地发生了反应
下列结论中正确的是
A.自发反应一定是放热反 B.自发反应一定是吸热反应
C.有的吸热反应也能自发进行 D.吸热反应不能自发进行
难度: 简单查看答案及解析
-
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混 合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
A.溶液中由水电离产生的H+浓度为1×10-7 mol/L
B.c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C.溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D.溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 简单查看答案及解析
-
某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是
编号
HX
YOH
溶液的体积关系
①
强酸
强碱
V(HX)=V(YOH)
②
强酸
强碱
V(HX)<V(YOH)
③[
强酸
弱碱
V(HX)=V(YOH)
④
弱酸
强碱
V(HX)=V(YOH)
A.①③ B.②③ C.①④ D.②④
难度: 简单查看答案及解析
-
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36,常温时下列有关说法正确的是
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为
1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
难度: 简单查看答案及解析
-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)=c(H+)+c(NH4+)
难度: 简单查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的
曲线如右图所示,下列描述正确的是
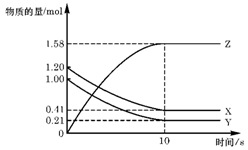
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B.反应开始时10s,X的物质的量浓度减少了0.79mol/L
C.反应开始时10s,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+ Y(g)
Z(g)
难度: 简单查看答案及解析
-
对达到平衡状态的可逆反应X+Y
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
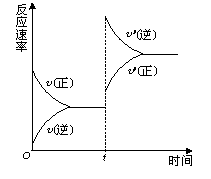
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体]
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
难度: 简单查看答案及解析
-
在一个V升的密闭容器中放入2L A气体和1L B气体,在一定条件下发生反应:3A(g)+ B(g) nC(g) + 2D(g),达到平衡后,A的浓度减小,混合气体的平均分子量增大,则该反应方程式中n值是
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
在一定温度下,可逆反应A(g) + 3B(g) 2C(g)达到平衡的标志是
A.A的生成速率与C的分解速率相等;
B.单位时间内生成n mol A,同时生成3n mol B;
C、A、B、C的浓度不再变化;
D、A、B、C的浓度之比为1:3:2
难度: 简单查看答案及解析
-
在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
难度: 简单查看答案及解析
-
已知AgCl(s)
Ag+ + Cl-,平衡时,c(Ag+)·c(C-) =Ksp ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中c(Ag+ )大小顺序为
A.③①②④ B.④①②③ C.①②③④ D.④③②①
难度: 简单查看答案及解析
-
(6分)在氢氟酸溶液中,存在如下电离平衡:HF H+ + F-
(1)加入固体NaOH ,电离平衡向________反应方向移动, c(H+)_______________。
(2)加入固体NaF , 电离平衡向________反应方向移动 , c(H+)____________。
(3)升高温度,电离平衡向__________反应方向移动,c(H+)_________________。
难度: 简单查看答案及解析
-
(4分)已知反应:aA(g) + bB(g) cC(g)
根据图形推测:
P1 _____P2 ( 填 > 或 < ) a + b _______c ( 填 > 或 < )
难度: 简单查看答案及解析
-
(8分) 按要求写热化学方程式:
(1) 已知稀溶液中,1 mol H2SO4与NaOH溶液
恰好完全反应时,放出114.6 kJ热量,
写出表示H2SO4与NaOH反应的中和热的热化学方程式
_________________________________________________________________.
(2) 25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式______________________________________________________.
(3) 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________________________________________.
难度: 简单查看答案及解析
-
(10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
难度: 简单查看答案及解析
-
( 8分) 将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B
2C,在反应过程中C的物质的量分数随温度变化如图所示:

(1) T0对应的反应速率V正和V逆的关系是_____(用含“>”“<”“=”表示,下同);
(2) 此反应的正反应为______热反应;
(3) X、Y两点A物质正反应速率的大小关系是______________;
(4) 温度T<T0时,C%逐渐增大的原因是________________________;
(5) 若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2min,则B物质的反应速率为__________。
难度: 简单查看答案及解析
-
( 4分) 通常条件下PbSO4是一种不溶于水、酸、碱溶液的白色沉淀。但是PbSO4却溶于CH3COONH4溶液得无色溶液(1)。在(1)溶液中再通入H2S气体形成黑色沉淀(2)。结合中学化学有关离子反应发生的条件、离子反应方程式书写规则,写出(1)(2)两种产物形成的离子方程式:
(1)________ ;
(2)。
难度: 简单查看答案及解析
-
(6分) 已知100g CaCO3(S)分解生成CaO(S)和CO2(g)需要吸收178kJ热量,12gC(S)燃烧生成CO2(g)放出393.5kJ热量,如果把0.5t CaCO3煅烧成CaO(S),在理论上要用C(S)燃料多少kg?
难度: 简单查看答案及解析
-
(6分) 将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2 + O2 2SO3 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
难度: 简单查看答案及解析