-
下列有关化学用语表示正确的是
A.对硝基甲苯的结构简式:
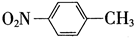
B.镁离子的结构示意图:
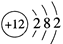
C.次氯酸的电子式:
D.亚硫酸钠水解的离子方程式:SO32- +2H2O
H2SO3+2OH-
难度: 中等查看答案及解析
-
下列各组离子在给定条件下一定能大量共存的是
A.水电离出的c(H+)=1×10-14 mol/L的溶液:K+、[Ag(NH3)2]+、Br-、Cl-
B.在含有Al3+、Cl-的溶液中:HCO3-、I-、NH4+、Mg2+
C.在c(H+)=1×10-13 mol·L-1的溶液中:Na+、S2-、SO32-、NO3-
D.在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1 molCl2与足量Fe反应转移电子数一定为3NA
B.标准状况下,2.24 L NH3中含有共价键的数目为NA
C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
D.标况下,11.2 L SO3所含的分子数目为0.5NA
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结 论
A 用铂丝蘸取溶液进行焰色反应 火焰呈黄色 溶液中无K+
B 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 溶液中一定含有SO42-
C 向一定浓度的CuSO4溶液中通入适量H2S气体 出现黑色沉淀 H2S的酸性比H2SO4强
D 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无
难度: 中等查看答案及解析
-
下列离子反应方程式中,书写正确的是
A.明矾溶液加入偏铝酸钠溶液:Al3++3AlO2-+6H2O=4Al(OH)3↓
B.氯化铁溶液与适量铜粉混合:Cu + Fe3+ = Cu2++ Fe2+
C.Fe3O4固体溶于足量稀硝酸溶液中:Fe3O4+8H+=2Fe3++ Fe2++ 4H2O
D.碳酸氢铵溶液与足量澄清石灰水混合:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
难度: 中等查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
A.若M(甲)>M(乙),则气体体积:甲<乙
B.若M(甲)<M(乙),则气体的压强:甲>乙
C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙
D.若M(甲)<M(乙),则的分子数:甲<乙
难度: 中等查看答案及解析
-
某有机物结构简式如图所示,下列有关该有机物叙述正确的是
A.该有机物分子式为C9H8O3
B.该有机物可以和氯化铁溶液发生显色反应
C.1 mo1该有机物与溴水反应,最多消耗2 mol Br2
D.1 mol该有机物最多与2 mol NaOH反应
难度: 中等查看答案及解析

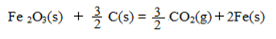 △H = +230 kJ/mol
△H = +230 kJ/mol