-
决定化学反应速率的主要原因是( )
A. 参加反应物质本身的性质 B. 反应物间的接触面积
C. 温度、压强和催化剂 D. 反应物的浓度
难度: 简单查看答案及解析
-
实验室要快速制取氢气,应选用正确的措施是( )
A.纯锌和稀硫酸反应 B.粗锌和浓硫酸反应
C.粗锌和稀硝酸反应 D.将浸泡过CuSO4(少量)溶液的锌与稀硫酸反应
难度: 简单查看答案及解析
-
下列分子中所有原子都满足最外层8电子结构的是 ( )
A、光气(COCl2) B、六氟化硫
C 二氟化氙 D、三氟化硼
难度: 简单查看答案及解析
-
我国稀土资源丰富。下列有关稀土元素 14462Sm与 15062Sm的说法正确的是( )
A. 14462Sm与 15062Sm互为同位素 B. 14462Sm与 15062Sm的质量数相同
C. 14462Sm与 15062Sm是同一种核素 D. 14462Sm与 15062Sm的核外电子数和中子数均为62
难度: 简单查看答案及解析
-
关于卤素(用X表示)的下列叙述中正确的为( )
A. 卤素单质与水反应的通式为X2+H2O= HX+HXO
B. HX都极易溶于水,它们的热稳定性随核电荷数增大而增强
C. 卤素单质的颜色随相对分子质量增大的顺序不断加深
D. X-的还原性随卤素的核电荷数增大而增强,核电荷数小的卤素单质可将核电荷数大的卤素从它的盐溶液里置换出来
难度: 简单查看答案及解析
-
关于原电池的下列说法中,不正确的是 ( )
A.在负极上发生氧化反应 B.化学性质较活泼的金属为负极
C.在外电路上电子由负极流向正极 D.是由电能转化为化学能的装置
难度: 简单查看答案及解析
-
对于可逆反应:2A(气) + 2B(气) ⇋3C(气) + D(固),减少压强产生的影响的是( )
A、正、逆反应速率都减慢,平衡向逆反应方向移动
B、正反应速率加快,逆反应速率减慢,平衡向正反应方向移动
C、逆反应速率加快,正反应速率减慢,平衡向逆反应方向移动
D、正、逆反应速率都不变,平衡向逆反应方向移动
难度: 简单查看答案及解析
-
有a、b、c、d四种金属,用导线两两相连插入稀硫酸中可以组成原电池, a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,a极发生氧化反应;b、d相连时,b极有大量气泡生成。则四种金属的活动性按由强到弱顺序排列的是( )
A、a>b>c>d B、a>c>d>b
C、c>a>b>d D、b>d>c>a
难度: 简单查看答案及解析
-
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上电子数比Y元素原子的L电子层上的电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( )
A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7
难度: 简单查看答案及解析
-
已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol;②稀溶液中,
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
A.稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
难度: 简单查看答案及解析
-
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成原电池——燃料电池,该电池放电时发生的反应为CH4+2KOH+2O2===K2CO3+3H2O,下列说法错误的是( )
A.通甲烷的一极为负极,通氧气的一极为正极
B.放电时,通入O2一极附近溶液的pH升高
C.放电一段时间后,KOH的物质的量不发生变化
D.通甲烷极的电极反应式是:CH4+10OH--8e-===CO32-+7H2O
难度: 简单查看答案及解析
-
下列四个数据是不同条件下测出的合成氨的反应的速率,其中最慢的是( )
A.v(NH3)=0.15 mol/L·min B.v(H2)=0.1 mol/L·min
C.v(N2)=0.1 mol/L·min D.v(N2)=0.002 mol/L·s
难度: 简单查看答案及解析
-
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g) ⇋ C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量
A.②③⑤ B.①②③
C.②③④⑤ D.①③④⑤
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
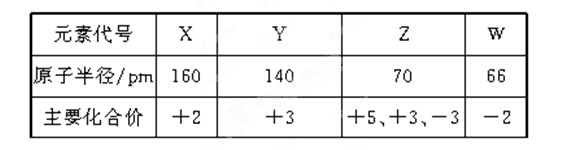
下列说法正确的是( )
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 简单查看答案及解析
-
如图所示装置中,观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
难度: 简单查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应, 2A(g) + B(g) ⇋ 2C(g) 若经 2 s 后测得 C 的浓度为 0.6 mol/L ,现有下列几种说法: ①用物质 A 表示的反应的平均速率为 0.3 mol/(L · s) ②用物质 B 表示的反应的平均速率为 0.6 mol/(L · s) ③ 2 s 时物质 A 的转化率为 70 % ④ 2 s 时物质 B 的浓度为 0.7 mol/L 其中正确是( )。
A .①③ B .①④ C .②③ D .③④
难度: 简单查看答案及解析
