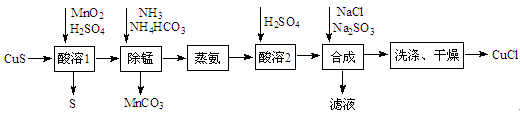
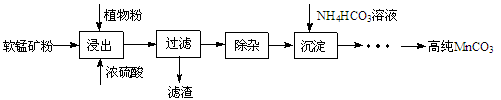
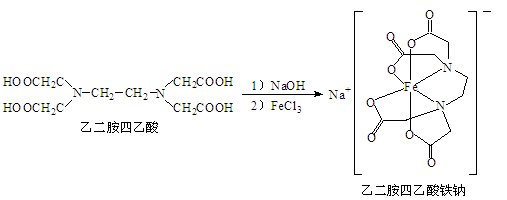
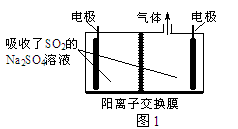
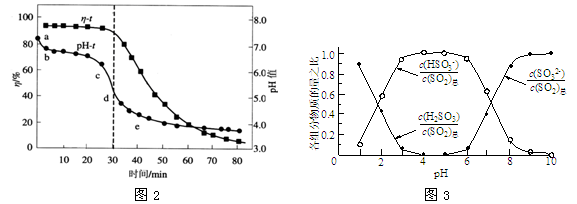
-
下列说法错误的是
A.使用可降解塑料聚二氧化碳,能减少白色污染
B.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境
C.雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮
D.通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.HClO的结构式:H—Cl—O
B.羟基的电子式:
C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
D.异丙醇的结构简式:CH3CH2CH2OH
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+
B.0.1 mol·L-1 FeCl3溶液中:Mg2+、NH4+、SCN-、SO42-
C.滴入甲基橙显黄色的溶液中: Na+、ClO-、I-、SO42-
D.水电离产生的c(H+)=10-12 mol·L-1的溶液中:K+、Na+、NO3-、CH3COO-
难度: 中等查看答案及解析
-
下列有关物质性质与应用对应关系错误的是
A.常温下,浓硫酸能使铝钝化,可用铝制容器贮运浓硫酸
B.二氧化硅熔点很高、硬度很大,可用于制造坩埚
C.氯化铁溶液能腐蚀铜,可用于制作印刷电路板
D.金属钠硬度小、密度小,可用于制造高压钠灯
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
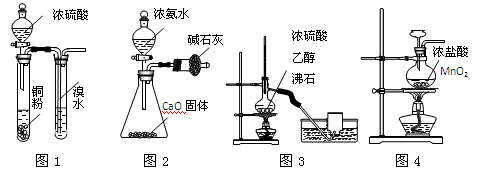
A.用图1所示装置验证浓硫酸具有强氧
化性
B.用图2所示装置制取干燥的NH3
C.用图3所示装置制取并收集乙烯
D.用图4所示装置制取Cl2
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2 L CCl4中含有的分子数为0.5 NA
B.1 mol Cl2完全溶于水,转移的电子数为NA
C.25°C时,pH=13的1.0 L Ba(OH)2溶液中含有的OH−数为0.1 NA
D.电解精炼铜,转移2 NA个电子时,阳极溶解64 g铜
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO+2H2O
B.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
C.氧化亚铁溶于稀硝酸:
3FeO + 8H+ + NO3-=3Fe3+ + NO↑+ 4H2O
D.4 mol·L-1的NaAlO2溶液和7 mol·L-1的盐酸等体积混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
难度: 困难查看答案及解析
-
X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
难度: 困难查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,它们原子的最外层电子数之和为16,A与D同主族,B+与A2-具有相同的电子层结构,C原子的最外层电子数等于A原子最外层电子数的一半,则下列叙述正确的是
A.B2A2和B2A中阴阳离子的个数比相同
B.原子半径的大小顺序:r(D)>r(C)>r(B)>r(A)
C.D的简单气态氢化物的热稳定性比A的强
D
.元素C的单质是一种高硬度、高熔点的金属
难度: 中等查看答案及解析
-
某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是

A.1 mo N2与3 mo H2充分反应可以放出92 kJ的热量
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该反应的焓变减小
D.正反应的活化能等于逆反应的活化能
难度: 困难查看答案及解析
-
下列有关说法正确的是
A.Na2CO3和NaOH都能抑制水的电离
B.0.1 mol·L-1Na2CO3溶液加水稀释,CO32-的水解程度增大,溶液pH减小
C.酸碱中和滴定实验中,锥形瓶需用待测液润洗2~3次后,再加入待测液
D.常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n
难度: 中等查看答案及解析
-
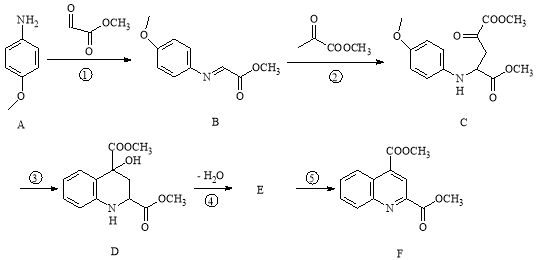
某药物中间体的合成路线如下。下列说法正确的是
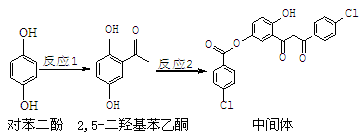
A.对苯二酚在空气中能稳定存在
B.1 mol该中间体最多可与11 mol H2反应
C.2,5-二羟基苯乙酮能发生加成、水解、缩聚反应
D.该中间体分子中含有1个手性碳原子
难度: 中等查看答案及解析
-
下列有关实验的说法错误的是
A.向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2
B.CO2中含少量SO2,可将该混合气体通入足量饱和NaHCO3溶液中除去SO2
C.用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐试样中不含KIO3
D.向NaHCO3溶液中滴加酚酞试液,加热时溶液由淡红色变为红色,冷却后溶液由红色变为淡红色,说明HCO3- 在水溶液中存在水解平衡
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1 NH4Cl溶液中:c(H+)=c(NH3·H2O)+c(OH-)
B.10 mL 0.1 mol·L-1 CH3COONa溶液与6 mL 0.2 mol·L-1盐酸混合:c(Cl-) > c(Na+) > c(OH-) > c(H+)
C.0.1 mol·L-1 NH4HSO4溶液与0.1 mol·L-1 NaOH溶液等体积混合:c(Na+) = c(NH4+) > c(H+) > c(OH-)
D.0.1 mol·L-1 HCN溶液和0.05 mol·L-1 NaOH溶液等体积混合(pH>7):c(HCN) + c(H+) > c(OH-) + c(CN-)
难度: 困难查看答案及解析
-
某温度时,向2.0 L恒容密闭容器中充入0.5 mol PCl5,发生反应
PCl5(g)
PCl3(g) + Cl2(g),经过一段时间后达到平衡。反应过程中测得部分数据如下,下列说法正确的是
t/s
0
50
100
250
350
n(PCl5)
0. 5
0.42
0.41
0.40
0.40
A.100 s时,c(PCl3)= 0.09 mol·L-1
B.保持其他条件不变,降低温度,平衡时c(PCl3)=0.045 mol·L-1,则该反应的ΔH <0
C.相同温度下,起始时向上述容器中充入0.25 mol PCl3、0.25 mol Cl2,达平衡时,PCl3的转化率小于80%
D.相同温度下,起始时向上述容器中充入0.20 mol PCl5、0.20 mol PCl3、0.10 mol Cl2,此时反应将向逆反应方向进行
难度: 困难查看答案及解析