-
下列叙述中,不能用平衡移动原理解释的是 ( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
C.高压比常压有利于合成SO3的反应
D.黄绿色的氯水光照后颜色变浅
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是 ( )
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
难度: 简单查看答案及解析
-
一定条件下反应2AB(g)
A2(g)+B2(g)达到平衡状态的标志是 ( )
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.容器的总压强不变
D.容器中各组分的体积分数不随时间变化
难度: 简单查看答案及解析
-
下列各组实验中溶液最先变浑浊的是( )
A.0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃
B.0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃
C.0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度30℃
D.0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度30℃
难度: 简单查看答案及解析
-
在C(s)+CO2(g)
2CO(g)反应中可使反应速率增大的措施是 ( )
①缩小容器的体积;②增加碳的量;③通入CO2;④恒压下充入N2 ;⑤恒容下充入N2;⑥通入CO
A.①③⑤ B.②④⑥ C.①③⑥ D.③⑤⑥
难度: 简单查看答案及解析
-
已知反应A2(g)+2B2(g)
2AB2(g)△H <0,下列说法正确的 ( )
A.升高温度有利于反应速率增加,从而缩短达到平衡的时间
B.升高温度,正向反应速率增加,逆向反应速率减小
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
难度: 简单查看答案及解析
-
从植物花汁中提取的一种有机物,可简化表示为HIn,在水溶液中因存在下列电离平衡,故可用作酸、碱指示剂:
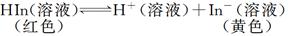
在上述溶液中加入下列物质,最终能使指示剂显黄色的是 ( )
A.盐酸 B.NaHCO3溶液 C.NaHSO4溶液 D.Na2O2(固体)
难度: 简单查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
A.A的转化率变大 B.平衡向正反应方向移动
C.a < c+d D.D的体积分数变大
难度: 简单查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象中正确的是( )

难度: 简单查看答案及解析
-
反应:L(s)+aG(g)
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
A.上述反应 △H<0 B.上述反应△H>0
C.a>b D.a<b
难度: 简单查看答案及解析
-
在醋酸中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
A.加水 B.加热 C.加CH3COONa固体 D.加很稀的NaOH溶液
难度: 简单查看答案及解析