-
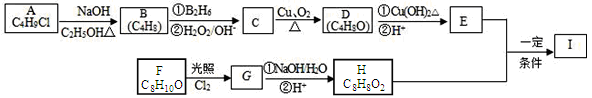
分子式为C5H8O2的有机物,能与NaHCO3溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)有
A.8种 B.10种 C.11种 D.12种
难度: 中等查看答案及解析
-
下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的
选项
微粒组
加入试剂
发生反应的离子方程式
A
Na+、Fe3+、Cl-、I-
NaOH溶液
Fe3++3OH-=Fe(OH)3↓
B
K+、NH3·H2O、CO32-
通入少量CO2
2OH-+CO2=CO32-+H2O
C
H+、Fe2+、SO42-、Cl-
Ba(NO3)2溶液
SO42-+Ba2+=BaSO4↓
D
Na+、Al3+、Cl-、NO3-
少量澄清石灰水
Al3++3OH-=Al(OH)3↓
难度: 简单查看答案及解析
-
下列应用利用了氧化还原反应原理的是
A.用“84消毒液”进行消毒 B.用浓硫酸干燥二氧化硫气体
C.用活性炭吸附新装修居室里的有害气体 D.用小苏打治疗胃酸过多
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数,下列叙述正确的是
A.7.8 g Na2O2中含有的阴离子数等于0.2NA
B.0.1 mol 16OD— 离子含有的电子、中子数均为1.0NA
C.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
难度: 简单查看答案及解析
-
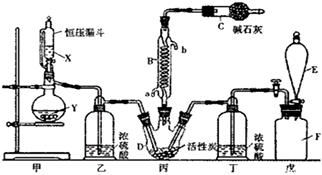
下列实验装置能达到实验目的的是

难度: 简单查看答案及解析
-
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为

A.2:1:2 B.1:2:2 C.2:2:1 D.9:2:4
难度: 简单查看答案及解析
-
已知含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是
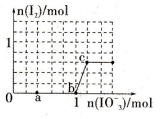
A.还原性:HSO3->I-,氧化性:IO3->I2>SO42-
B.a点处的氧化产物是SO42-,还原产物是I-
C.当溶液中的I-为0.4 mol时,加入的KIO3一定为0.4 mol
D.若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O
难度: 简单查看答案及解析