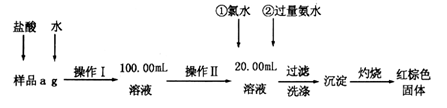
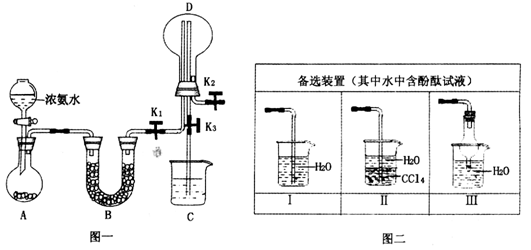
-
化学已渗透人类生活的各个方面。下列说法不正确的是
A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.“光化学烟雾”、“自氧空洞”的形成都与氮氧化合物有关
C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D.高铁酸钾(K2FeO4)是新型高效多功能水处理剂,既能消毒杀菌又能净水
难度: 中等查看答案及解析
-
下表各组物质或概念之间,不符合右图所示关系的是

难度: 中等查看答案及解析
-
下列关于物质的用途或变化,说法正确的是
A.生产玻璃和水泥都要用到的原料是石灰石
B.常温下,金属铝不被空气中的氧气氧化,因而能做导线
C.二氧化硅属于硅酸盐材料,玻璃钢属于复合材料
D.Al2O3熔点很高,可用作熔融NaOH的坩埚材料
难度: 中等查看答案及解析
-
下列与化学概念有关的说法正确的
A.酸性氧化物都是非金属氧化物
B.电离是电解质离解成自由移动离子的过程,与是否通电无关
C.强电解质和水混合后都以自由移动的离子形式存在
D.熔融状态能导电的物质一定是离子化合物
难度: 中等查看答案及解析
-
下列实验现象描述正确的是
A.新制饱和氯水在光照下有气泡产生,其主要成分是氯气
B.二氧化硫通入紫色石蕊试液中,溶液先变红后退色
C.钠在空气中燃烧,黄色火花四射,生成黄色固体
D.金属铜放置在潮湿的空气中生成绿色的铜锈(碱式碳酸铜)
难度: 中等查看答案及解析
-
下列叙述正确的是
A.浓硫酸可干燥H2、SO2、NH3等气体
B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生
C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质
D.足量的硫单质与64g铜反应,有2mol电子发生转移
难度: 中等查看答案及解析
-
下列各组物质中,不能按如图所示关系一步完成转化的是
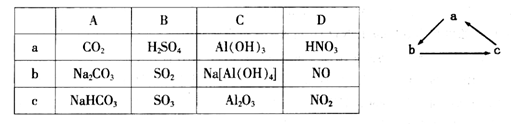
难度: 中等查看答案及解析
-
下列说法正确的是
A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023
B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023
C.2.24LSO2与O2混合气体中所含氧原子数为0.2×6.02×1023
D.Vlamol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
难度: 中等查看答案及解析
-
Cl、
Cl为不同的核素,下列说法正确的是
A.
Cl2的摩尔质量是74
B.通常情况下,氯气做氧化剂,但氯气也具有还原性
C.
Cl、
Cl互为同位素,
Cl2与
Cl2互为同素异形体
D.常温下,4.48L
Cl2含有8NA个中子(NA为阿伏加德罗常数的值)
难度: 中等查看答案及解析
-
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等
难度: 中等查看答案及解析
-
依据元素周期表及元素周期律,下列推断正确的是
A.HCl、HBr、HI的热稳定性依次增强
B.若M+和R2-的核外电子层结构相同,则原子序数:R>M
C.同主族元素从上到下,单质的熔点逐渐降低
D.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
难度: 中等查看答案及解析
-
在pH=1的无色溶液中,下列各离子组因发生氧化还原反应而不能共存的是
A.NH4+ K+ Na+ CO32- NO3-
B.K+ Na+ Fe2+ SO42- NO3-
C.NH4+ K+ Na+ HCO3- [Al(OH)4]-
D.NH4+ K+ Na+ NO3- I-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.钠溶于水:2Na+H2O=2Na++OH-+H2↑
B.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.亚硫酸氢钠溶液中滴加硫酸氢钠溶液:H++HSO3-=SO2↑+H2O
D.向0.1mol·L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应
难度: 中等查看答案及解析
-
关于反应的先后顺序,下列评价正确的是
A.向浓度都为0.1mol·L-1Na2CO3和NaOH混合溶液中通入CO2,NaOH首先反应
B.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应
C.向浓度都为0.1mol·L-1的FeCl3和CuCl2混合溶液中加入铁粉,CuCl2首先反应
D.向0.1mol·L-1的FeCl3溶液中加入质量相同、颗粒大小相同的铁和铜,铜首先反应
难度: 中等查看答案及解析
-
不用其他试剂无法鉴别的一组溶液是
A.氯化铁溶液和氯化铜溶液
B.硫酸钠溶液和氯化钠溶液
C.氯化铝溶液和氢氧化钠溶液
D.硫酸溶液和碳酸钠溶液
难度: 中等查看答案及解析
-
下列对于某些离子的检验及结论一定正确的是
A.加入盐酸产生无色气体,将气体通入石灰水中,溶液变浑浊,一定有CO32-
B.向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C.滴加KSCN溶液后呈红色,一定有Fe3+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
某溶液中含有下列六种离子:①HCO3- ②SO32- ③Na+ ④CO32- ⑤NH4+ ⑥NO3-,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是
A.只有⑥ B.④⑥ C.③④⑥ D.①②⑤
难度: 中等查看答案及解析
-
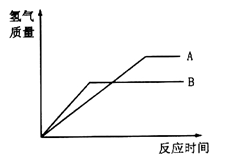
向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
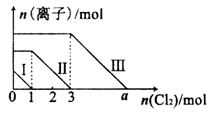
A.线段III代表Fe2+的变化情况
B.线段I代表Br-的变化情况
C.a值等于6
D.原混合溶液中
难度: 中等查看答案及解析
-
化工生产中通常有“三酸两碱”之说,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是__________,(填化学式)。
(2)向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是__________(填序号)。
A.浓H2SO4具有脱水性
B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是______(填序号);
A.Au B.Ag C.Al D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式__________________________。
(4)烧碱、纯碱溶液均可吸收CO2气体。当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温小于蒸干,称得固体质量为8g,则所得固体是____________(填化学式)。
难度: 中等查看答案及解析
-
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。
(1)下列说法正确的是_________(填序号)。
A.解毒剂美蓝应该具有氧化性 B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原 D.中毒过程中血红蛋白显氧化性
(2)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O从上述反应推知________(填序号)。
A.氧化性:I2
NaNO2 B.氧化性:NaNO2
I2
C.还原性:HI
NO D.还原性:I2
HI
(3)根据上述反应,可用试纸和生活中常见的物质进行实验来鉴别NaNO2和NaCl。现供选用的物质有:①白酒 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋,进行本实验时,可以选用的物质至少有__________(填序号)。
(4)某工厂的废液中含有2%~5%的NaNO2,直接排放会造成污染。下列试剂中:①NaCl②NH4Cl ③HNO3 ④浓H2SO4,能使NaNO2转化为N2的是_______(填序号)。
难度: 中等查看答案及解析
-
阅读下表中短周期主族元素的相关信息。
元素代号 相关信息
A A的单质能与冷水剧烈反应,得到强碱性溶液
B B的原子最外层电子数是其内层电子数的三倍
C 在第3周期元素中,C的简单离子半径最小
D A、B、D组成的36电子的化合物X是家用消毒剂的主要成分
E 所有有机物中都含有E元素
(1)E在元素周期表中的位置__________;C的简单离子的结构示意图_______。
(2)X的化学式为____________。
(3)A、B、C三种元素形成的简单离子的半径由大到小的顺序为___________(用离子符号表示)。
(4)A在真空压下能与由元素D、E组成的化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式______________________。
难度: 中等查看答案及解析