-
下列关于元素周期律和元素周期表的说法中正确的是( )
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着原子序数的增加而呈周期性变化
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.最外层电子数为8的粒子是稀有气体元素的原子
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 乙醇做燃料易燃烧,污染小,但不可再生
B.选择燃料需要考虑燃料热值的大小
C.若反应物总能量大于生成物总能量则反应为放热反应
D. 将煤制成水煤气提高燃料的利用率
难度: 简单查看答案及解析
-
判断下列有关化学基本概念的依据正确的是( )
A.氧化还原反应:元素化合价发生变化 B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小 D.金属晶体:晶体是否能够导电
难度: 简单查看答案及解析
-
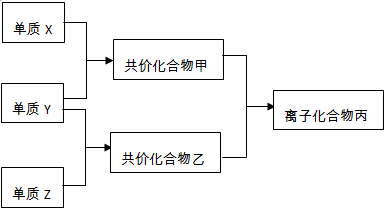
科学家发现铂的两种化合物:a为
 ,b为
,b为 ,两者有不同的特性,a比b易溶于水。则a与b的关系为( )
,两者有不同的特性,a比b易溶于水。则a与b的关系为( )A.同分异构体 B.同素异形体 C.同位素 D.同种物质
难度: 简单查看答案及解析
-
在实验室欲加速制取氢气,最好的方法是采用( )
A.纯锌跟稀硫酸溶液 B.纯锌与稀盐酸
C.粗锌(含少量铜)跟稀硫酸溶液 D.粗锌(含少量铜)跟醋酸溶液
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A 失电子难的原子获得电子的能力一定强
B 离子化合物的熔点一定比共价化合物的高
C 非金属元素组成的化合物一定是共价化合物
D 含有阴离子的化合物一定含有阳离子
难度: 简单查看答案及解析
-
下列反应中,浓硝酸既表现氧化性,又表现出酸性的是( )
①浓硝酸中滴入石蕊试液并微热 ②氧化亚铁与浓硝酸反应 ③氢氧化铝与浓硝酸反应④碳与浓硝酸
A.①② B.③④ C.①④ D.②③
难度: 简单查看答案及解析
-
下列指定微粒的个数比为2:1的是( )
A.Be2+离子中的质子和电子
B.
H原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
难度: 简单查看答案及解析
-
下列判断错误的是( )
A.沸点:NH3>PH3>AsH3 (As:第四周期,VA元素)
B.熔点:SiO2>NaCl>SiI4
C.酸性:HClO4>H2SO4>H3PO4
D.碱性:NaOH>Mg(OH) 2>Al(OH)3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.干冰升华和液氯气化时要破坏不同的微粒间作用力
B.CO2和SiO2具有相同的化学键类型和晶体类型
C.水结成冰体积膨胀、密度变小,这一事实与水中存在氢键有关
D.盐酸能电离出氢离子和氯离子,所以HCl存在离子键
难度: 简单查看答案及解析
-
下列物质性质的变化规律,与共价键的键能大小有关的是( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金属锂、钠、钾的熔点依次降低
D.NaF、NaCl、NaBr、NaI的熔点依次降低
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触锡先被腐蚀
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4mol电子通过
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.P4和NO2都是共价化合物
B.H2S的电子式是
C.在CaO和SiO2晶体中,都不存在单个小分子
D. 甲烷的结构式:
,是对称的平面结构
难度: 简单查看答案及解析
-
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A、质子数c>b B、离子的还原性Z-> Y2-
C、氢化物的稳定性H2Y>HZ D、原子半径X>W
难度: 简单查看答案及解析
-
在下列各组溶液中,离子一定能大量共存的是 ( )
A、强碱性溶液中:Na+、K+、SO42-、CO32-
B、含有HClO的溶液中:K+、NH4+、Cl-、SO32-
C、某无色溶液中:H+、Fe2+、MnO4-、NO3-
D、在pH=1的溶液中:Na+、K+、CH3COO-、AlO2-
难度: 简单查看答案及解析
-
在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42―离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
难度: 简单查看答案及解析
-
如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体。假设试管内的溶质不向水槽中扩散,则两个试管内溶液物质的量浓度之比为 ( )
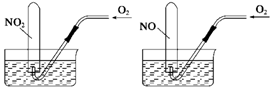
A.1∶1 B.5∶7 C.7∶5 D.4∶3
难度: 简单查看答案及解析
-
短周期元素X,Y,Z在周期表中的位置如图所示,则下列说法中错误的是( )
X
Y
Z
A.X,Y,Z中X的单质最稳定 B.Y的氢化物为HY
C.X能生成HXO D.能发生Cl2+H2Z = Z+2HCl的反应
难度: 简单查看答案及解析
-
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z<Y<X
难度: 简单查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:

下列描述正确的是( )
A. 反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)
B. 反应开始到10s,X的物质的量浓度减少了0.79mol/L
C. Y的转化率为79.0%
D. 反应的化学方程式为:X(g)+ Y(g)
Z(g)
难度: 简单查看答案及解析
-
.在一定温度下,向a L密闭容器中加入1molX气体和2 molY气体,发生如下反应:X(g) + 2Y(g)
2Z(g) 此反应达到平衡的标志是( )
A.正反应和逆反应的速率都为零 B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1∶2∶2 D.单位时间消耗0.1molX同时生成0.2molZ
难度: 简单查看答案及解析
-
下列各组热化学方程式中,化学反应的△H1大于△H2的是( )
①C(s)+O2(g)===CO2(g);△H1 ; C(s)+1/2O2(g)===CO(g);△H2
②2H2(g)+O2(g)==2H2O(g)△H1 ; 2H2(g)+O2(g)==2H2O(l)△H2
③H2(g)+Cl2(g)==2HCl(g)△H1 ; 1/2H2(g)+1/2Cl2(g)==HCl(g)△H2
④CaCO3(s)===CaO(s)+CO2(g);△H1 ; CaO(s)+H2O(l)===Ca(OH)2(s);△H2
A.①③ B.①④ C.②④ D.②③
难度: 简单查看答案及解析