-
氯元素在自然界有35Cl和37C1两种同位素,在计算式34.969×75.77 %+36.966×
24.23%=35.453中 ( )
A.75.77%表示35C1的质量分数 B.24.23%表示35C1的浓度
C.35.453表示氯元素的相对原子质量 D.36. 966表示37C1的质量数
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B.NH4HCO3(s)=====NH3(g)+H2O(g)+CO2(g)△H="+185.57" kJ·mol-1,能自发进行,原
因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自
发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
难度: 中等查看答案及解析
-
在密闭容器内充入4 mol S02和3mol 02,在一定条件下建立平衡:
2SO2(g)+02(g)
2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
则在此条件下反应放出的热量为( )
A.1.8Q kJ B.2Q kJ C.Q kJ D.0.9 QJ
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.N2的电子式:
B.S2-的结构示意图:
C.NH4Br的电子式:
D.原子核内有l8个中子的氯原子:
难度: 中等查看答案及解析
-
已知一定温度下,下列反应的平衡常数:H2(g)+S(s)
H2S(g) K1,
S(s)+02(g)
SO2(g) K2。则相同温度下反应H2(g)+SO2(g)
O2(g)+H2S(g)的
平衡常数为( )
A.K1+K2 B.K1-K2 C.K1·K2 D.K1/K2
难度: 中等查看答案及解析
-
已知反应:3A(g)+B(g)
2C(g)+2D(g) △H<0。右图中曲线a、b分别表示在不同条件下,A与B反应时,D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采用的措
施是( )
①增大A的浓度 ②升高温度
③增大D的浓度④加入催化剂
⑤恒温下,缩小反应容器的体积
⑥加入稀有气体,保持容器内压强不变
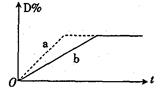
A.①②③ B.④⑤ C.③④⑤ D.④⑤⑥
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.IA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 中等查看答案及解析
-
下列有关化学反应速率的描述中正确的是 ( )
A.在任何化学反应中,只要提高反应温度,就可提高反应速率
B.在任何化学反应中,只要增大某一反应物的用量,就会增大反应速率
C.在任何化学反应中,增大压强时,都会使反应速率增大
D.在任何化学反应中,只要缩小容器的体积,都会使反应速率增大
难度: 中等查看答案及解析
-
下表是部分短周期元素的相关信息:
元素代号
L
M
T
Q
R
原子半径/nm
0.154
0.130
0.118
0.102
0.073
主要化合价
+1
+2
+3
+6、-2
-2
下列判断正确的是( )
A.沸点:H2Q>H2R
B. 碱性:T(OH)3>M(OH)2
C. T和Q 两者最高价氧化物对应的水化物可以发生反应
D. L与R形成的化合物中只能含有离子键
难度: 困难查看答案及解析
-
一定温度下,在固定容积的密闭容器中,有可逆反应mA(g)+nB(g)
pC(g)+qD(g),
当m、n、p、q为任意正整数时,下列状态:
①体系的压强不再发生变化 ②体系的密度不再发生变化
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q,
其中一定能说明反应已达到平衡的是( )
A. 只有③④ B. ②③④
C. ①②③④ D. ①②③④⑤
难度: 困难查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
 若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
难度: 困难查看答案及解析
-
在一化学平衡状态体系中,发生下列量的变化,其中一定会使平衡发生移动的是( )
A.反应物的浓度 B.反应物的转化率
C.正、逆反应速率 D.体系的压强
难度: 中等查看答案及解析
-
某温度下,将2 mol A和3 mol B充入一密闭的容器中,发生反应:
xA(g)+B(g)
C(g)+D(g),5 min后达到平衡。已知各物质的平衡浓度关系为
cx(A)·c(B)=c(C)·c(D),若在温度不变的情况下将容器的体积扩大为原来的10倍,
A的转化率不发生变化,则B的转化率为( )
A. 40% B. 60% C. 24% D. 4%
难度: 中等查看答案及解析
-
有关化学平衡常数(K)的说法中不正确的是( )
A.K值越大,正反应进行的程度越大
B.一般地说,K>105时,该反应进行得就基本完全了
C.压强越大,K值越大
D.K与反应物或生成物的浓度变化无关
难度: 中等查看答案及解析
-
可逆反应在一定条件下达到平衡后,速率差值[即v(正)—v(逆)]与压强的变化曲线如右图所示,其中与曲线①相符的反应为( )
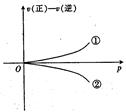
A.2SO3(g)
2SO2(g)+02(g)
B.H2(g)+I2(g)
2HI(g)
C.C(s)+H2O(g)
C0(g)+H2(g)
D.N2(g)+3H2(g)
2NH3(g)
难度: 中等查看答案及解析
-
在密闭容器中,一定条件下进行反应:mA(g)+nB (g)
pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,随时间变化过程均如图所示,则对该反应的叙述中正确的是( )
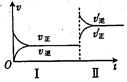
A.正反应是放热反应,m+n<p+q
B.逆反应是放热反应,m+n>p+q
C.正反应是放热反应,m+n>p+q
D.逆反应是放热反应,m+n<p+q
难度: 中等查看答案及解析
-
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)
zC(g) △H<0。
达到化学平衡后测得A的浓度为0.5 mol·L-1;在恒温下,将密闭容器的容积压缩至
原来的二分之一,再次达到平衡时,测得A的浓度为0.9 mol·L-1。则下列叙述中
正确的是( )
A. 平衡向正反应方向移动了 B. x+y<z
C. B的转化率下降 D. C的体积分数减小
难度: 困难查看答案及解析
-
反应:2X (g)+Y(g)
2Z(g)在不同温度和压强下的产物Z的物质的量和反应时
间t的关系如下图所示:下列判断正确的是( )

A.P1>P2 T1>T2△H<0
B.P1>P2 T1<T2△H<0
C.P1<P2 T1>T2△H>0
D.P1<P2 T1<T2△H>0
难度: 中等查看答案及解析