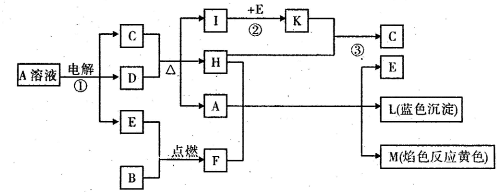
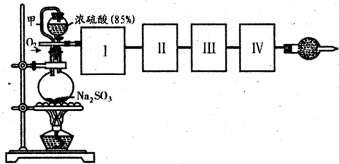
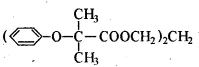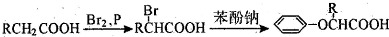-
生产、生活中的-些问题常常涉及到化学知识,下列叙述不正确的是( )
A.稻草、秸秆焚烧后的灰烬可以为庄稼提供肥料,所以应提倡稻草、秸秆的焚烧
B.用稀双氧水清洗伤口可以杀菌消毒
C.日本大地震后,防疫人员在震区周围撒石灰进行环境消毒,防止灾后出现疫情
D.尽量购买本地的、当季的食物,符合节能、低碳生活理念难度: 中等查看答案及解析
-
某澄清透明溶液,当溶液呈强酸性时,有气体放出,当溶液呈强碱性时,有白色沉淀生成.则该溶液中可能大量共存的离子组是( )
A.K+、Ba2+、NO3-、S2-
B.NH4+、Fe3+、Cl-、ClO-
C.K+、Ca2+、Br-、HCO3-
D.Na+、Al3+、S-、CH3COO-难度: 中等查看答案及解析
-
下列热化学方程式或离子方程式中,正确的是( )
A.在CH4、02和KOH溶液组成的燃料电池中,负极反应式为:CH4-8e-+10OH-=CO32-+7H2O
B.在5000C、30Mpa条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g) 2NH3(g);△H=-38.6kJ/mol
2NH3(g);△H=-38.6kJ/mol
C.乙烯的燃烧热为akJ/mol(a>0),则乙烯燃烧的热化学方程式可表示为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g););△H=-akJ/mol
D.向苯酚钠(C6H5ONa)溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→2C6H5OH+CO32-难度: 中等查看答案及解析
-
阿伏加德罗常数用NA表示,下列叙述正确的是( )
①常温常压下,2.24L D2气体分子含有的中子数为小于0.2NA
②含有0.32克氧元素的二氧化硅中含有的硅氧键数目为0.02NA
③0.44gC3H8中含有的极性共价键总数目为0.1NA
④7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA
⑤46g二氧化氮与四氧化二氮的混合气体的平均分子量46<M<92
⑥11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA
⑦1mol冰醋酸和1mol乙醇在加热和浓硫酸的条件下充分反应生成的水分子数为NA.
A.①③④⑤⑥
B.②③④⑤⑥
C.②④⑤⑥⑦
D.①④⑤难度: 中等查看答案及解析
-
瘦肉精,是一种非常廉价的药品,对于减少脂肪增加瘦肉作用非常好.瘦肉精有很危险的副作用,轻则导致心律不整,严重一点就会导致心脏病.下列关于两种常见瘦肉精的说法不正确的是( )
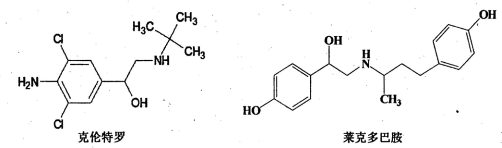
A.克伦特罗和莱克多巴胺均能发生加成、氧化、消去等反应
B.克伦特罗分子中所有的碳原子可以在同一平面内
C.克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D.莱克多巴胺与足量Na2CO3溶液反应,生成物的化学式为C18H21NO3Na2难度: 中等查看答案及解析
-
下列实验操作正确的是( )
①用稀硫酸洗涤长期存放石灰水的试剂瓶;
②用带橡胶塞的棕色试剂瓶存放浓硫酸;
③用盐酸酸化过的FeCl3溶液,除去H2还原CuO实验留在试管内的铜;
④测定某溶液的pH时,先用蒸馏水润湿pH试纸,再甩洁净、干燥的玻璃棒蘸取该溶,液点在试纸上,并与标准比色卡比较;
⑤分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出;
⑥蒸馏时,将温度计的水银球靠近蒸馏烧瓶支管口.
A.①③
B.②③④
C.②③
D.③⑤⑥难度: 中等查看答案及解析
-
右表是元素周期表中短周期的一部分,已知A元素的原子中最外层电子数是其电子层数的3倍.下列关于表中六祌元素的说法不正确的是( )
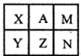
A.X元素形成的气态氢化物分子空间结构呈三角锥形
B.X、Y、Z三种元素形成的单核阴离子半径中Y最大
C.X的氢化物分子间存在氢键,因此X的熔沸点较高
D.最高价氧化物对应的水化物酸性最强的元素是M元素难度: 中等查看答案及解析
-
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4,NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO+NO2+2NaOH=2NaNO2+H2O则生成的盐溶液中NaNO3的物质的量为( )
A.0.4mol
B.0.2mol
C.0.6mol
D.0.8mol难度: 中等查看答案及解析