-
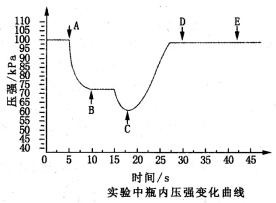
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
难度: 困难查看答案及解析
-
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列 关于:KNO3的古代文献,对其说明不合理的是

难度: 中等查看答案及解析
-
下列物质分类正确的是
A.SO2、SiO2、CO均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.盐酸、水玻璃、氨水均为混合物 D.烧碱、冰醋酸、四氯化碳均为电解质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.18 g H2O含有10NA个质子
B.7.8 g
Na2O2中含有的阴离子数是0.2NA
C.标准状况下,22.4 L氨水含有NA个NH3分子
D.56 g铁片投入足量浓H2SO4中生成NA个SO2分子
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.胶体的丁达尔效应与微粒直径大小有关
B.明矾能水解生成Al(OH)3胶体,可用作水的消毒剂
C.可用半透膜除去淀粉溶液中的少量NaCl
D.向饱和氯化钠溶液中加入一小块钠,恢复原温度后溶液中有固体析出
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 12C与14C为不同核素 B. 石墨和C60互为同素异形体
C. H2O和D2O互为同位素 D.
与
为同种元素
难度: 简单查看答案及解析
-
下列有关非金属元素说法正确的是
A.二氧化氯具有还原性,可用于自来水的杀菌消毒
B.液氨汽化时要吸收大量的热,可用作制冷剂
C.硫具有还原性,可用硫粉覆盖地上洒落的汞
D.硅是重要的半导体材料,常用于制作光导纤维
难度: 简单查看答案及解析
-
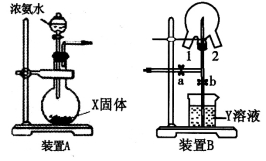
亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是
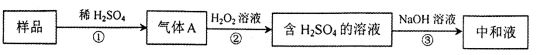
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H
2O2溶液”替换为碘水,对测定结果无影响
难度: 中等查看答案及解析
-
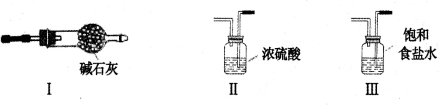
关于下列各实验装置的叙述中,不正确的是
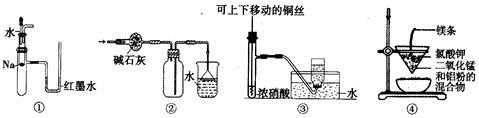
A. 装置①可用于验证Na与H2O反应是否放热
B. 装置②可用于干燥、收集NH3,并吸收多余的NH3
C. 装置③可用于制备并收集少量NO
D. 装置④可制得金属锰
难度: 中等查看答案及解析
-
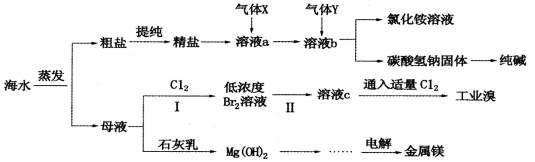
常温常压下CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO
的质量之比可能为
A.13:8:27 B.13:9:27
C.26:16:27 D.286:8:27
难度: 简单查看答案及解析
-
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量
CO2生成Al(OH)3沉淀
⑤加入盐酸,生成Al(OH)3沉淀⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③
C.②③⑤③ D.①③⑤③
难度: 中等查看答案及解析
-
下列陈述I和Ⅱ均正确,并存在因果关系的是
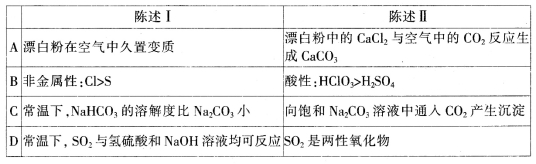
难度: 中等查看答案及解析
-
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
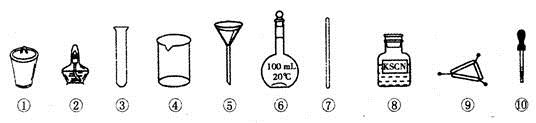
A. 将茶叶灼烧灰化,选用②、④和⑨
B. 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦
C. 过滤得到滤液,选用④、⑤和⑦
D. 检验滤液中的Fe3+,选用③、⑧和⑩
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的K
I:5I-+IO3-+3H2O=3I2+6OH-
B.将过量SO2通入冷氨水中:SO2+NH3+H2O=HSO3-+NH4+
C.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
NH3↑+H2O
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
难度: 中等查看答案及解析
-
CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6 mol·L-1,则此溶液最多溶解铁粉的质量为
A.5.6g B.11.2g C.22.4g D.33.6g
难度: 中等查看答案及解析
-
在常温下,发生下列几种反应
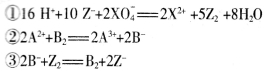
根据上述反应,下列结论判断错误的是
A.溶液中可发生:Z2+2A2+=2A3++2Z-
B.Z2在①③反应中为氧化剂
C.氧化性强弱的顺序为:XO4->Z2>B2>A3+
D.X2+是XO4-的还原产物
难度: 中等查看答案及解析
-
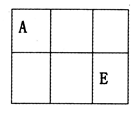
.已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是
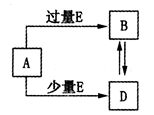
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是AlCl3溶液,E可能是氨水
D.若A是NaOH溶液,E是CO2,则B为NaHCO3
难度: 中等查看答案及解析
-
某无色稀溶液X中,可能含有如表所列离子中的某几种。
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示。下列说法正确的是
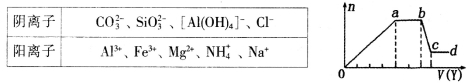
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、[Al(OH)4]-和NH4+
B.若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4
难度: 极难查看答案及解析