-
2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构.这种超原子具有40个价电子时最稳定.请预测稳定的Al13所带的电荷为( )
A.3+
B.2+
C.0
D.1-难度: 中等查看答案及解析
-
下列氧化还原反应中,水既不作氧化剂、又不作还原剂的是( )
A.CO+H2OCO2+H2
B.SO2+H2O=H2SO3
C.2Na2O2+2H2O=4NaOH+O2↑
D.2F2+2H2O=4HF+O2难度: 中等查看答案及解析
-
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O下列说法正确的是( )
A.制高铁酸钾用ClO-做还原剂
B.制备高铁酸钾时1molFe(OH)3得到3mol电子
C.高铁酸钾中铁的化合价为+6,其氧化性强于ClO-的氧化性
D.用高铁酸钾处理水时,利用了其强氧化性,且其还原产物能水解产生具有强吸附能力的胶体难度: 中等查看答案及解析
-
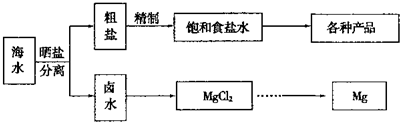
实验室进行NaC1溶液蒸发时,一般有以下操作过程
①固定铁圈位置②放置酒精灯③放上石棉网④放上蒸发皿⑤加热搅拌⑥停止加热、余热蒸干
其操作顺序为( )
A.①②③④⑤⑥
B.②①③④⑤⑥
C.②①④⑤⑥
D.②①③④⑤难度: 中等查看答案及解析
-
有200mLMgCl2和AlCl3混合液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,欲将Mg2+、Al3+恰好转化为沉淀,需加4mol/LNaOH溶液( )
A.65mL
B.40mL
C.72mL
D.128mL难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.一定条件下,足量铜与200g98%的硫酸溶液充分反应,转移电子数目为NA
B.常温下,10LpH=3的醋酸溶液中H+的数目为0.01NA
C.22.4L由CO2和O2组成的混合气体中含有氧原子个数为2NA
D.18gD2O中含质子数为10NA难度: 中等查看答案及解析
-
在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种.①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色.根据上述实验事实推断,下列说法不正确的是( )
A.溶液中一定存在Br-、CO32-
B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32-
D.溶液一定呈碱性难度: 中等查看答案及解析