-
若甲烷与氯气以物质的量之比1︰3混合,在光照下得到的产物:①CH3Cl;②CH2Cl2;③CHCl3;④CCl4,其中正确的是( )
A. 只有① B. 只有②
C. ①②③的混合物 D. ①②③④的混合物
难度: 中等查看答案及解析
-
下列各项中表达正确的是 ( )
A. 次氟酸的结构式为H-F-O B. CH4分子的球棍模型:
C. 1H、D、3T2互为同位素 D. CO2电子式:
难度: 简单查看答案及解析
-
下列说法中正确的一组是( )
A.正丁烷和异丁烷是同系物
B.CH3CH2CH2CH(C2H5)CH3 和 C2H5CH(CH3)CH2CH2CH3是同一种物质
C.H2和D2互为同位素
D.
和
互为同分异构体
难度: 中等查看答案及解析
-
下列分子式表示的物质一定是纯净物的是
A. C B. C2H6O C. C3H8 D. C2H4Cl2
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A. ①③ B. ②③ C. ①④ D. ②④
难度: 中等查看答案及解析
-
可逆反应2SO2(g) +O2(g)
2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是
A. υ(SO2) =0.5mol/(L•s) B. υ(O2) =1mol/(L•min)
C. υ(SO3) =0.6mol/(L•s) D. υ(O2) =0.4mol/(L•s)
难度: 中等查看答案及解析
-
为验证甲烷分子中含有C、H两种元素,可将其燃烧产物通过①浓硫酸;②澄清石灰水;③无水硫酸铜。正确的顺序是( )
A. ①②③ B. ②③ C. ②③① D. ③②
难度: 中等查看答案及解析
-
已知:CH4(g)+2O2(g)=2CO2(g)+2H2O(l) △H=-Q1 2H2(g)+O2(g)=2H2O(g) △H=-Q2 2H2(g)+O2(g)=2H2O(l) △H=-Q3常温下取体积比为4:1的CH4和H2的混合气体11.2L(标况)经完全燃烧后恢复至常温,放出的热量是( )
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D. 0.4Q1+0.2Q2
难度: 中等查看答案及解析
-
纽约一家公司设计出Soccket足球,每被踢一下,就会把能量储存起来;被储存的能量可以通过USB 接口给手机等充电。在Soccket足球充放电的过程中,下列有关能量转化的说法中正确的是

A. 踢球时,化学能转化为电能 B. 踢球时,电能转化为机械能
C. 手机充电时,电能转化为化学能 D. 手机充电时,化学能转化为电能
难度: 简单查看答案及解析
-
下列各组中两个反应的反应热,其中△H1>△H2
A. 2H2(g)+O2(g)=2H2O(g) △H1;2H2(g)+O2(g)=2H2O(l) △H2
B. S(g)+O2(g)=SO2(g) △H1;S(s)+O2(g)=SO2(g) △H2
C. 2SO2(g)+O2(g)=2SO3(g) △H1;2SO3(g)=O2(g)+2SO2(g) △H2
D. 已知反应:C(金刚石,s)=C(石墨,s)ΔH<0,C(金刚石,s)+O2(g)=CO2(g) △H1;C(石墨,s)+O2(g)=CO2(g) △H2
难度: 简单查看答案及解析
-
甲:在试管中加入1 g粉末状大理石,加入4 mol/L盐酸20 mL(过量);
乙:在试管中加入2 g颗粒状大理石,加入4 mol/L盐酸20 mL(过量);
下列CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图合理的是
A.
 B.
B. 
C.
 D.
D. 
难度: 简单查看答案及解析
-
如图装置,通电后,发现Cu极附近溶液蓝色加深。下列说法正确的是( )

A. A极为负极,Cu为阳极
B. 左烧杯溶液和右烧杯溶液的pH都变小
C. 左烧杯溶液浓度变大,右烧杯溶液浓度不变
D. 左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1
难度: 简单查看答案及解析
-
锌﹣溴蓄电池的充、放电的电池总反应为Zn+Br2
 Zn2++2Br﹣,下列各反应:①Zn﹣2e﹣=Zn2+;②Br2+2e﹣=2Br﹣;③2Br﹣﹣2e﹣=Br2;④Zn2++2e﹣=Zn,其中电的阳极和放电的负极的反应分别是( )
Zn2++2Br﹣,下列各反应:①Zn﹣2e﹣=Zn2+;②Br2+2e﹣=2Br﹣;③2Br﹣﹣2e﹣=Br2;④Zn2++2e﹣=Zn,其中电的阳极和放电的负极的反应分别是( )A. ①② B. ③② C. ④② D. ③①
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是:
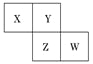
A. 只由这四种元素不能组成有机化合物
B. 最高价氧化物对应水化物的酸性W比Z弱
C. Z的单质与氢气反应较Y剧烈
D. X、Y形成的化合物都易溶于水
难度: 中等查看答案及解析
-
普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag。下列有关说法正确的是( )

A. 2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与 2 mol Ag具有的总能量
B. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu流向Ag2O
D. 电池工作时,OH-向正极移动
难度: 中等查看答案及解析
-
某同学按右图所示的装置进行电解实验。下列说法正确的是(双选)( )

A. 电解过程中,铜电极上有H2产生
B. 电解初期,主反应方程式为:Cu+H2SO4
CuSO4+H2↑
C. 电解一定时间后,石墨电极上有铜析出
D. 整个电解过程中,H+的浓度不断增大
难度: 中等查看答案及解析
-
以下四种基团:—CH3、—CH2—、
可组合成烷烃分子。若某烷烃分子中同时且只存在这四种基团,则该烷烃含有的碳原子数最少为( )
A. 4 B. 5 C. 8 D. 9
难度: 中等查看答案及解析
-
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况。下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应;②过量的氢气与少量的N2在工业生产条件下;③过量的浓盐酸与碳酸钙反应;④过量的KI溶液和少量FeCl3溶液反应;⑤过量二氧化锰与浓盐酸在加热条件下;⑥过量的铜与浓硫酸在加热条件下
A. ②③④⑥ B. ②④⑤⑥ C. ①②④⑤ D. ③④⑤⑥
难度: 中等查看答案及解析
-
已知某些共价键的键能如下表所示,火箭燃料肼(N2H4)的燃烧的热化学方程式是:N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-5a kJ·mol-1。则O-H的键能为
共价健
N-N
N-H
O=O
N≡N
键能kJ·mol-1
3a
2.5a
4a
8a
A. 2a kJ·mol-1 B. 2.5a kJ·mol-1
C. 3a kJ·mol-1 D. 3.5a kJ·mol-1
难度: 简单查看答案及解析
 ⑨C60。
⑨C60。