-
根据同分异构体的概念,判断下列物质互为同分异构体的是( )
A. CH3﹣CH2﹣NO2 和 H2N﹣CH2﹣COOH
B. H和D
C. 甲烷和正丁烷
D. 红磷和白磷
难度: 简单查看答案及解析
-
下列物质在生活中应用时,起还原作用的是
A.明矾作净水剂
B.甘油作护肤保湿剂
C.漂粉精作消毒剂
D.铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
下列有关硅及其化合物的说法,正确的是
A. 硅在自然界中只以化合态的形式存在
B. 单质硅常用作半导体和光导纤维材料
C. SiO2与纯碱高温生成CO2,说明硅酸的酸性比碳酸强
D. SiO2是非金属氧化物,它不与任何酸反应
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应,又是放热反应的是
A. 铝片与稀硫酸的反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的炭与CO2的反应 D. 红热的焦炭与水蒸气的反应
难度: 简单查看答案及解析
-
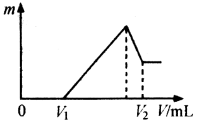
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子组成HmX分子,在ag HmX 中所含质子的物质的量是
A.
(A-N+m)mol B.
(A-N)mol
C.
( A-N)mol D.
(A-N+m)mol
难度: 困难查看答案及解析
-
下列现象或应用不能用胶体知识解释的是
A. 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B. 牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐有固体析出
C. 氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D. 水泥厂、冶金厂常用静电除尘法除去工厂烟尘,减少对空气污染
难度: 简单查看答案及解析
-
下列结论错误的是( )
①微粒半径:K+>Al3+>S2﹣>Cl﹣
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2﹣>Cl﹣>Br﹣>I﹣
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
⑧沸点:H2Se>H2S>H2O.
A. ①⑤ B. ①③⑤⑧ C. ②④⑥⑦ D. ②④⑥
难度: 中等查看答案及解析
-
一定条件下,在容积固定的某密闭容器中发生反应N2+3H2
2NH3。在10s内N2的浓度由5mol/L降至4mol/L,下列说法正确的是( )
A.用NH3表示的化学反应速率为0.1 mol/(L·s)
B.使用合适的催化剂,可以加快该反应的速率
C.增加H2的浓度或降低温度都会加快该反应的速率
D.反应足够长时间,N2、H2中至少有一种物质浓度降为零
难度: 简单查看答案及解析
-
下列化学用语正确的是 ( )
A.氮分子的电子式:
B.硫原子的结构示意图:
C.溴化钠的电子式:
D.水分子的结构式:
难度: 中等查看答案及解析
-
断裂下列化学键需要吸收的能量分别为H-H键436KJ/mol;F-F键153 KJ/mol H-F键565KJ/mol下列说法正确的是
A. H2与F2反应需要吸收能量
B. 2LHF气体分解成1LH2和1L F2吸收541 KJ的能量
C. 在相同条件下,1molH2和1LmolF2的能量总和大于2molHF气体的能量
D. 1molH2和1LmolF2反应生成2mol液态HF放出的能量小于541 KJ
难度: 简单查看答案及解析
-
在恒容密闭容器
中进行反应:X2(g)+3Y2(g)
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,当反应达到平衡后,各
物质的浓度有可能是
A.X2为0.2 mol·L-1 B.Y2为0.1 mol·L-1
C.Z2为0.4mol·L-1 D.Y2为0.6 mol·L-1
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
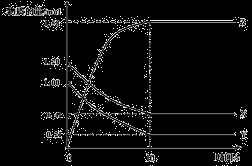
下列描述正确的是( )
A、反应开始到10s,用Z表示的反应速率为0.158 mol·L-1·s-1
B、反应开始到10s,X的物质的量浓度减少了0.79 mol·L-1
C、反应开始到10s,Y的转化率为79.0%
D、反应的化学方程式为:X(g) + Y(g)
Z(g)
难度: 中等查看答案及解析
-
现有如下说法:①在离子化合物里,只存在离子键,没有共价键。②金属和非金属只能化合形成离子键。③离子键是阳离子、阴离子的相互吸引。④在PCl5、CCl4中各原子最外层均能达到8电子的稳定结构。⑤共价键只存在于共价化合物中。上述各种说法正确的是
A. ①②⑤正确 B. 都不正确
C. ④正确,其他不正确 D. 仅①不正确
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是
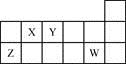
A. 原子半径的大小顺序:rZ>rY>rX
B. Y的简单氢化物水溶液呈酸性
C. Y的氢化物与W的氢化物不能发生反应
D. X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 中等查看答案及解析
-
一定温度下,在恒容密闭容器中进行可逆反应2NO2(g)
2NO(g) + O2(g),下列可以作为反应达到化学平衡状态标志的有:①单位时间内生成nmol O2的同时生成2nmol NO2②单位时间内生成nmol O2的同时生成2nmol NO③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态④混合气体的颜色不再改变的状态⑤密闭容器中压强不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑤⑥ B.②③⑤⑥ C.①③④⑥ D.全部
难度: 中等查看答案及解析