-
生物学家借助新的显微技术,成功观察到小于200纳米的微粒。下列分散系中,分散质粒径最小的是
A. 雾 B. 蛋白质溶液
C. 石灰乳 D. KNO3溶液
难度: 简单查看答案及解析
-
下列物质与常用危险化学品的类别不对应的是
A.
、
——腐蚀品 B.
——易燃液体
C.
——遇湿易燃物品 D.
——氧化剂
难度: 中等查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A. SO3 与SO2 B. BF3 与NH3 C. BeCl2与SCl2 D. H2O 与SO2
难度: 中等查看答案及解析
-
下列每组中的各物质内均既有离子键又有共价键的一组是( )
A. NaOH、H2SO4、(NH4)2SO4 B. MgO、 Na2SO4、NH4HCO3
C. Na2O2、KOH、Na2SO4 D. HCl、Al2O3、MgCl2
难度: 中等查看答案及解析
-
下列物质的熔、沸点高低顺序中,正确的是 ( )
A. 金刚石>晶体硅>二氧化硅>碳化硅
B. CI4>CBr4>CCl4>CH4
C. MgO>H2O>O2>Br2
D. 金刚石>生铁>纯铁>钠
难度: 中等查看答案及解析
-
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
A.K+、SiO32﹣、Cl﹣、NO3﹣ B.H+、NH4+、Al3+、SO42﹣
C.Na+、S2﹣、OH﹣、SO42﹣ D.Na+、AlO2﹣、CH3COO﹣、HCO3﹣
难度: 简单查看答案及解析
-
某短周期元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1)。下列有关X的说法中不正确的是 ( )
A. X能与某些金属元素形成化合物
B. X可能形成化学式为KXO3的含氧酸钾盐
C. X不可能为第一周期元素
D. 由X形成的含氧酸均为强酸
难度: 中等查看答案及解析
-
下列说法正确的是
A. 分子晶体中一定存在分子间作用力,不一定存在共价键
B. 分子中含两个氢原子的酸一定是二元酸
C. 含有金属阳离子的晶体一定是离子晶体
D. 元素的非金属型越强,其单质的活泼性一定越强
难度: 中等查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O= H2SO4+2HBr相比较,水的作用不相同的是( )
①2Na2O2+2H2O= 4NaOH+O2↑
②4Fe(OH)2+O2+2H2O= 4Fe(OH)3
③2F2+2H2O= 4HF+O2
④2Al+2NaOH+2H2O= 2NaAlO2+3H2↑
A. ①③ B. ①④ C. ③④ D. ②④
难度: 中等查看答案及解析
-
早在2007年3月21日,我国就公布了111号元素Rg的中文名称。该元素名称及所在周期是
A.
第七周期 B. 镭 第七周期
C. 铼 第六周期 D. 氡 第六周期
难度: 简单查看答案及解析
-
某无机化合物的二聚分子结构如图,该分子中A、B两种元素都是第三周期的元素,分子中所有原子最外层都达到8电子稳定结构。关于该化合物的说法不正确的是( )
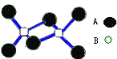
A. 化学式是Al2Cl6
B. 不存在离子键和非极性共价键
C. 在固态时所形成的晶体是分子晶体
D. 是离子化合物,在熔融状态下能导电
难度: 简单查看答案及解析
-
化合物A、B、C都只含有两种元素,且A、B均含X元素。已知一定条件下可发生反应:A+B——X+C,X是一种单质,由此可知X元素 ( )
A. 一定是金属元素 B. 一定是非金属元素
C. 可能是金属元素,也可能是非金属元素 D. 无法确定
难度: 困难查看答案及解析
-
有关下列说法正确的是 ( )
A. 2.3g钠与97.7g水反应后,溶液的质量分数为4%
B. 钠与CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出了金属铜
C. 将金属钠与水反应后的溶液中通入适量的氯气后,溶液中含有两种盐
D. 钠在空气中的缓慢氧化与其在空气中点燃的产物一样
难度: 中等查看答案及解析
-
某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合物,经测定ClO﹣与ClO3﹣的物质的量之比为11:1,则Cl2与KOH反应时,被还原的氯原子和被氧化的氯原子的物质的量之比
A. 1:3 B. 4:3 C. 2:1 D. 3:1
难度: 简单查看答案及解析
-
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
难度: 困难查看答案及解析
-
在含a mol FeCl3溶液中加入含b mol Fe和b mol Cu的混合粉末充分反应(忽略离子的水解),下列说法中不正确的是
A. 当a≤2b时,发生的离子反应为2Fe3++Fe===3Fe2+
B. 当2b≤a≤4b时,反应中转移电子的物质的量n(e-)为2b mol≤n(e-)≤4b mol
C. 当2a=5b时,发生的总离子反应为10Fe3++4Fe+Cu===14Fe2++Cu2+
D. 当2b<a<4b时,反应后的溶液中n(Fe2+)∶n(Cu2+)=
(a-2b)∶(a+b)
难度: 困难查看答案及解析

