-
化学与科学、技术、社会、环境密切相关。下列说法不正确的是
A. 含有食品添加剂的物质均对人体健康有害
B. 聚乙烯是无毒高分子化合物,可用作食品包装
C. “地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D. 太阳能电池板中有高纯硅单质,光导纤维的主要成分是二氧化硅
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式是( )
A. 氯气溶于水:Cl2 + H2O = 2H+ + Cl-+ ClO-
B. 用碳酸钠溶液吸收少量二氧化硫:
=
C. NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O = Fe(OH)2↓ + 2HClO
D. NaHSO4溶液与Ba(OH)2溶液反应至中性: H++SO42—+Ba2++OH— = BaSO4↓+H2O
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )
A.18g D2O中含有的中子数为10NA
B.64g铜发生氧化还原反应失去的电子数可能为NA
C.标准状况下,11.2L已烯中含有的碳原子数为3NA
D.25℃时,1mol·L-1醋酸溶液中所含CH3COOH分子总数一定小于NA
难度: 中等查看答案及解析
-
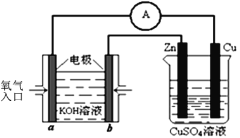
一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)
Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法正确的是( )

A. Cl-由负极区向正极区迁移
B. Ag为负极,Pt为正极
C. Cu+在Pt电极表面发生氧化反应
D. Ag极的电极反应为Ag-4e-+Cl-
AgCl
难度: 困难查看答案及解析
-
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水。下列说法不正确的是( )
A. 单质D可用于冶炼某些难熔金属
B. 工业上常用电解法制得C和D的单质
C. 稳定性:A2B>A2E
D. 简单离子的半径:C>D>E>B
难度: 简单查看答案及解析
-
分子式为C5H11Cl,在NaOH溶液中加热反应,生成的有机物在Cu的催化作用下加热反应,氧化产物能发生银镜反应的有(不考虑立体异构)( )
A. 2种 B. 4种 C. 6种 D. 8种
难度: 中等查看答案及解析
-
常温下,0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合后(忽略混合前后溶液体积的变化),溶液的pH<7,则下列有关此溶液的叙述正确的是
A. 溶液中由水电离产生的H+浓度为1×10-7mol/L
B. c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L
C. 溶液中CH3COOH的电离程度小于CH3COONa的水解程度
D. 溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析