-
下列变化属于化学变化的是
A. 海水晒盐 B. 油脂皂化 C. 石油分馏 D. 苯萃取碘
难度: 简单查看答案及解析
-
锂常用来制造高能量电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法
A. 热还原法 B. 热分解法 C. 电解法 D. 铝热法
难度: 简单查看答案及解析
-
能被酸性高锰酸钾溶液氧化的物质是
A. 乙烷 B. 乙醇 C. 苯 D. 乙酸
难度: 简单查看答案及解析
-
下列说法正确的是
A. 异丁烷与新戊烷互为同系物
B. 一氯甲烷在常温下为液态
C. 淀粉与纤维素互为同分异构体
D. 酯化反应属于加成反应
难度: 简单查看答案及解析
-
下列关于碱金属和卤素的说法正确的是
A. 随着原子序数的增大,密度均增大 B. 随着原子序数的增大,熔沸点均升高
C. 最高正价均等于主族序数 D. 电子层数均等于周期序数
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. 质子数为17、中子数为20的氯原子:
B. 硫离子的结构示意图:
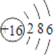
C. 次氯酸的电子式:
D. 葡萄糖的结构简式:C6H12O6
难度: 简单查看答案及解析
-
除去乙烷中混有的乙烯杂质可选用的物质为
A. 氧气 B. 氢气 C. NaOH溶液 D. 溴水
难度: 简单查看答案及解析
-
分子式为C4H10O且能与金属钠反应放出氢气的有机物有
A. 4种 B. 5种 C. 6种 D. 7种
难度: 简单查看答案及解析
-
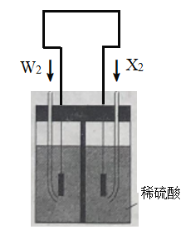
某同学用如图所示实验来探究构成原电池的一般条件,下列说法中正确的是

A. 左瓶的灯泡发光
B. 右瓶的铜棒变粗
C. 右瓶中铁棒为正极
D. 左瓶:Fe−2e−===Fe2+
难度: 简单查看答案及解析
-
原子经济性反应是指原料中的原子全部转化为产物,不产生副产品,实现零排放。下列反应中不符合原子经济性的是
A.
B. CH2=CH2+Cl2+Ca(OH)2→
+CaCl2+H2O
C.
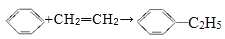
D. CO+2H2→CH3OH
难度: 简单查看答案及解析
-
一定条件下,在一恒容密闭容器中,下列能表示反应:X(g)+2Y(g)
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1:2:2;②Y的消耗速率与Z的消耗速率相等;③容器中的压强不再发生变化;④单位时间内生成n mol Z的同时消耗nmol Y
A. ①② B. ①④ C. ③④ D. ②③
难度: 简单查看答案及解析
-
下列实验装置或操作不能达到相应实验目的的是
A. 分离苯和溴苯
 B. 灼烧干海带
B. 灼烧干海带 C. 用四氯化碳提取碘水中的碘
C. 用四氯化碳提取碘水中的碘 D. 冶炼金属铁
D. 冶炼金属铁
难度: 简单查看答案及解析
-
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断下列叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.037
0.143
0.186
0.102
0.074
主要化合价
+1
+3
+1
+6、-2
-2
A. Q+与T2-的核外电子数相等
B. L与T形成的化合物不可能含非极性键
C. 最高价氧化物对应水化物的碱性:Q<M
D. R2-的还原性小于T2-的还原性
难度: 简单查看答案及解析
-
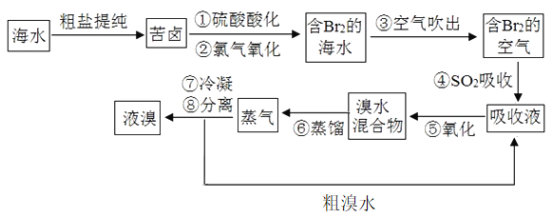
海水的综合利用可以制备金属钠和镁等,其流程如图所示。
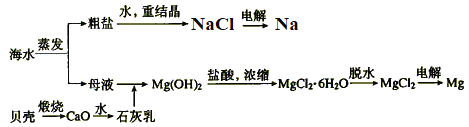
下列说法正确的是
A. 电解NaCl溶液可得到金属钠
B. 上述过程中发生了分解、化合、置换、复分解反应
C. 上述流程中生成Mg(OH)2沉淀的离子方程式为Mg2++2OH-=Mg(OH)2↓
D. 不用电解MgO来制取镁是因为MgO的熔点比MgCl2的高,能耗大
难度: 中等查看答案及解析
-
一定温度下,10 mL 0.40 mol/LH2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
12
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
a
下列叙述正确的是(溶液体积变化忽略不计)
A. 0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol·L-l·min-l
B. 反应到6 min时,c(H2O2)=0.30mol·L-l
C. 反应到6 min时,H2O2分解了60%
D. 12 min时,a=33.3
难度: 简单查看答案及解析