-
在下列各说法中,正确的是( )
A. ΔH>0表示放热反应,ΔH<0表示吸热反应
B. 热化学方程式中的化学计量数只表示物质的量,可以是分数
C. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
难度: 中等查看答案及解析
-
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是( )
A. C(s)+1/2 O2(g)=CO(g) △H= ―393.5 kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= ―890.3 kJ/mol
D. C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H=―2800 kJ/mol
难度: 中等查看答案及解析
-
下列各组热化学方程式中,ΔH1>ΔH2 的是
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g)ΔH1 S(g)+O2(g)===SO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH1 H2(g)+O2(g)===2H2O(l) ΔH2
④CaCO3(s)===CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH2
A. ① B. ④ C. ②③④ D. ①②③
难度: 中等查看答案及解析
-
在36g碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+1/2(g)=CO(g) △H=-110.5kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol
与这些碳完全燃烧相比,损失的热量是
A. 172.5kJ B. 1149kJ C. 283kJ D. 517.5kJ
难度: 困难查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是
A. 碳酸钙受热分解 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. 氧化钙溶于水
难度: 中等查看答案及解析
-
根据以下三个热化学方程式:
2H2S(g)+3O2(g)==2SO2(g)+2H2O(l) ΔH=-Q1 kJ/mol
2H2S(g)+O2(g)==2S(s)+2H2O(l) ΔH=-Q2 kJ/mol;
2H2S(g)+O2(g)==2S(s)+2H2O(g) ΔH=-Q3 kJ/mol。
判断Q1、Q2、Q3三者关系正确的是:( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
B. 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C. 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D. 催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
难度: 中等查看答案及解析
-
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ― Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
则0.4mol甲烷和0.1mol氢气的混合气体经完全燃烧后恢复至常温,则放出的热量为( )KJ。
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
难度: 中等查看答案及解析
-
下列对化学反应热现象的说法正确的是
A. 放热反应发生时不必加热
B. 化学反应一定有能量变化
C. 吸热反应加热后才能发生
D. 化学反应的热效应数值与参加反应的物质的多少无关
难度: 简单查看答案及解析
-
能增加反应物分子中活化分子的百分数的是
A. 升高温度 B. 减小压强 C. 增大压强 D. 增大浓度
难度: 简单查看答案及解析
-
已知H2(g)+Cl2(g)=2HCl(g) △H=―184.6kJ·mol-1, 则反应HCl(g)=
H2(g)+
Cl2(g)的△H为 ( )
A. +184.6kJ·mol-1 B. ―92.3kJ·mol-1
C. ―369.2kJ·mol-1 D. +92.3kJ·mol-1
难度: 中等查看答案及解析
-
在2A + B = 3C + 4D的反应中,下列表示该反应的化学反应速度最快的是( )
A、v (A) = 0.5 mol/(L·s) B、v (B) = 0.3 mol/(L·s)
C、v (C) = 0.8 mol/(L·s) D、v (D) = 1.0 mol/(L·s)
难度: 简单查看答案及解析
-
在2L的密闭容器中,发生以下反应:2A(g)+ B(g)
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
难度: 中等查看答案及解析
-
一定条件下反应2AB(g)
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
难度: 简单查看答案及解析
-
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+
O2(g) == H2O(1) △H= ―285.8kJ/mol
难度: 中等查看答案及解析
-
已知热化学方程式:
SO2(g)+1/2O2(g)
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A.196.64 kJ B.196.64 kJ/mol C.<196.64 kJ D.>196.64 kJ
难度: 中等查看答案及解析
-
石墨和金刚石都是碳的单质,石墨在一定条件下可转化为金刚石。已知把石墨完全转化为金刚石时,要吸收能量,下列说法正确的是
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的金刚石与石墨完全燃烧,放出的能量一样多
D.等质量的金刚石与石墨完全燃烧,石墨放出的能量多
难度: 中等查看答案及解析
-
已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1) ΔH = -285.8kJ/mol
当 1g 液态水变为水蒸气时,其热量变化是
A. 吸热 88kJ B. 吸热 2.44KJ C. 放热 44kJ D. 吸热 44KJ
难度: 中等查看答案及解析
-
已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol下列结论正确的是
A. 碳的燃烧热为110.5 kJ/mol
B. ①的反应热为221 kJ/mol
C. 稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
难度: 中等查看答案及解析
-
根据热化学方程式:S(l)+O2(g)===SO2(g) ΔH=-293.23 kJ·mol-1 ,分析下列说法中正确的是( )
A.S(s)+O2(g)===SO2(g),反应放出的热量大于293.23 kJ·mol-1
B.S(g)+O2(g)===SO2(g),反应放出的热量小于293.23 kJ·mol-1
C.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和
D.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和
难度: 中等查看答案及解析
-
反应 3Fe(s)+4H2O(g)⇌Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A. Fe 的量
B. 将容器的容积缩小一半
C. 保持容积不变,充入水蒸气使体系压强增大
D. 压强不变,充入 N2 使容器容积增大
难度: 中等查看答案及解析
-
在 298 K、100 kPa 时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则 ΔH1 与 ΔH2 和 ΔH3 间的关系正确的是
A. ΔH3=ΔH1+2ΔH2 B. ΔH3=ΔH1+ΔH2
C. ΔH3=ΔH1-2ΔH2 D. ΔH3=ΔH1-ΔH2
难度: 中等查看答案及解析
-
对达到平衡状态的可逆反应:A+B⇌C+D,若 t1 时增大压强,正、逆反应速率变化如图所示(ν 代表反应速率,t 代表时间),下列有关 A、B、C、D 的状态叙述中正确的是
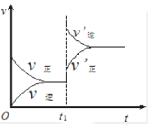
A. A、B、C 是气体,D不是气体
B. A、B 是气体, C、D 有一种是气体
C. C、D 是气体,A、B 有一种是气体
D. C、D 有一种是气体,A、B 都不是气体
难度: 中等查看答案及解析
-
容积固定为 3 L 的某密闭容器中加入 1 mol A、2 mol B,一定温度下发生如下反应:A(s)+2B(g)⇌ C(g)+D(g),经反应 5 min 后,测得 C 的浓度为 0.3 mol·L -1 。则下列说法中正确的是
A. 5 min 内 D 的平均反应速率为 0.02 mol·L·1 ·min -1
B. 5 min 内 A 的平均反应速率为 0.06 mol·L·1·min -1
C. 经 5 min 后,向容器内再加入 C,正反应速率变小
D. 平衡状态时,生成 1 mol D 时同时生成 1 mol A
难度: 中等查看答案及解析
-
亚氯酸盐(NaClO2)可作漂白剂,在常温下不见光时可保存一年,但在酸性溶液里因生成
亚氯酸而发生分【解析】
5HClO2=4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量 ClO2,这是因为A. 酸使亚氯酸的氧化性增强
B. 溶液中的 H+起催化剂的作用
C. 溶液中的 Cl-起催化剂的作用
D. 逸出的 ClO2 使反应的生成物的浓度降低
难度: 中等查看答案及解析