-
三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是
A.氯化硼液态时能导电而固态时不导电
B.硼原子以sp3杂化
C.氯化硼遇水蒸气会产生白雾
D.氯化硼分子属极性分子
难度: 中等查看答案及解析
-
在多电子原子中,轨道能量是由以下哪些因素决定
①电子层 ②电子亚层 ③空间伸展方向 ④自旋状态
A.①② B.①④ C.②③ D.③④
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.如果某一基态原子3p轨道上仅有2个电子,它们自旋方向必然相反
D.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
难度: 中等查看答案及解析
-
已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是
A.3S2p3 B.4S2 C.4S24P1 D.3S23p5
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是
A.最高正化合价:③>②>① B.第一电离能:③>②>①
C.电负性:③>②>① D.原子半径:③>②>①
难度: 中等查看答案及解析
-
A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素的原子序数可能为
A.a-4 B.a+8 C.a-5 D.a+4
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物,X显负价,Y显正价
B.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
C.气态氢化物的稳定性:HmY小于HnX
D.第一电离能Y一定小于X
难度: 中等查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是
A.CO2与H2O B. BeCl2与BF3 C.CH4与NH3 D.C2H2与C2H4
难度: 中等查看答案及解析
-
下列关于丙烯(CH3CH=CH2)的说法正确的是
A.丙烯分子有7个σ键和1个π键
B.丙烯分子存在非极性键
C.丙烯分子中3个碳原子都是sp3杂化面上
D. 丙烯分子中有3个碳原子在同一直线上
难度: 中等查看答案及解析
-
用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是
A.直线形;平面三角形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;三角锥形
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后[Cu(H2O)4]2+的数目不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后的深蓝色溶液中加入乙醇,不会产生任何现象
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 中等查看答案及解析
-
关于化学式[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是
A.配位体是Cl-和H2O,配位数是8
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl-的数目比是1:2
D.在1mol该配合物中加入足量AgNO3溶液,可以得到3molAgCl沉淀
难度: 中等查看答案及解析
-
某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60。下列对该分子的叙述中正确的是
A.分子中Si60被包裹在C60里面 B.形成的晶体属于分子晶体
C.其摩尔质量为2400 D.熔点高、硬度大
难度: 中等查看答案及解析
-
下列关于SiO2和金刚石的叙述正确的是
A.SiO2晶体结构中,每个Si原子与2个O原子直接相连
B.通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
C.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
D.1 mol金刚石含4 mol C-C键
难度: 中等查看答案及解析
-
要使金属晶体熔化必须破坏其中的金属键,金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,由此判断下列说法正确的是
A.金属镁的熔点高于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的
C.金属镁的硬度小于金属钙
D.金属铝的硬度大于金属钠
难度: 中等查看答案及解析
-
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是
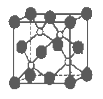
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
难度: 中等查看答案及解析