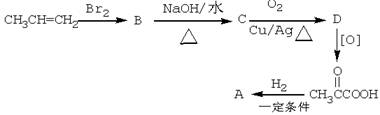
-
下列说法正确的是:
A.医用酒精、冰醋酸、液态HCl都是混合物
B.水晶、玛瑙和刚玉的主要成分都是二氧化硅
C.淀粉、油脂和蛋白质都能发生水解反应
D.铁遇到冷的浓硝酸和稀硝酸均会钝化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是:
A.常温下,28g 乙烯含有NA个C=C键
B.1molCl2和足量NaOH溶液反应转移2NA个电子
C.1 L 0.1 mol·L-1NaHCO3溶液含有0.1NA个CO32-
D.标况下,22.4升的乙醇含有NA个分子
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是:
A.氯化铝溶液和过量的氨水反应:Al3++4NH3·H2O=AlO2-+4NH4+
B.少量的CO2通入NaOH溶液中:CO2+2OH-=CO32-+H2O
C.醋酸加入小苏打溶液中:HCO3-+H+=CO2↑+H2O
D.硫化钠的水【解析】
S2-+2H2OH2S+2OH-
难度: 中等查看答案及解析
-
下列有关用惰性电极电解AgNO3溶液的说法不正确的是:
A.电解过程中阴极质量不断增大
B.电解过程中阳极附近的pH不断降低
C.电解一段时间后,向溶液中加入适量的Ag2O固体可使溶液恢复到电解前的状况
D.电解过程中,溶液中电子由阴极迁向阳极
难度: 中等查看答案及解析
-
下列说法正确的是:
A. 金属钠着火可用煤油扑灭
B.将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体
C向含有等量NaI、NaCl的溶液中滴加AgNO3溶液,先产生白色沉淀;
D. 用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+
难度: 中等查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是:
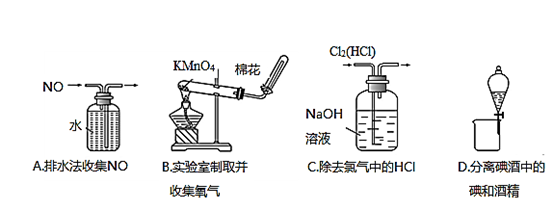
难度: 中等查看答案及解析
-
如图是元素周期表短周期元素的一部分。已知M最高价氧化物对应的水化物为常见的氧化性酸,下列说法正确的是:
A.M为氮元素
B.原子半径:Y>X
C.氢化物沸点:X>N
D.M、X、Y三种元素的最高价氧化物对应的水化物均为强酸
难度: 中等查看答案及解析
-
关于浓度相等的三种溶液:①H2CO3;②NaOH;③Na2CO3溶液,下列说法正确的是:
A.水电离出的c(H+):③>①>②
B.溶液的pH:③>②>①
C.①和②等体积混合后的溶液:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.①和③等体积混合后的溶液:c(Na+)+ c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
难度: 困难查看答案及解析