-
化学与社会、生活、科技等密切相关。下列说法正确的是
A. 泡沫灭火器可用于一般的起火,也适用于电器起火
B. 二氧化硅用途广泛,制光导纤维、石英坩埚、太阳能电池等
C. 向氨水中逐滴加入5-6滴FeCl3饱和溶液,制得氢氧化铁胶体
D. 绿色化学的核心就是利用化学原理从源头上减少或消除工业生产对环境的污染
难度: 中等查看答案及解析
-
下列表示不正确的是( )
A. 氯离子的结构示意图
 B. 四氯化碳分子的电子式:
B. 四氯化碳分子的电子式: C. CH4的球棍模型
D. 明矾的化学式:KAl(SO4)2·12H2O
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A.
的中子数和质子数之差为115
B. 浓硝酸显黄色是因为含有Fe3+
C. 二氧化硫和氯气使品红溶液褪色的原理相同
D. 长石(KAlSi3O8)用氧化物形式可表示为K2O·Al2O·6Si02
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 1.8gH218O与D20的混合物中含有的质子数和电子数均为NA
B. 精炼铜,若阳极失去0.1NA个电子,则阴极增重3.2g
C. 取50mL14.0mol/L浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA
D. 标准状况下,22.4LHF所含有的分子数目小于NA
难度: 中等查看答案及解析
-
植物提取物-香豆素,可用于消灭鼠害。其分子球棍模型如图所示。由C、H、0三种元素组成。下列有关叙述不正确的是( )

A. 该分了中不含手性碳原子
B. 分子式为C10H8O3
C. 能使酸性KMnO4溶液褪色
D. lmol香豆素最多消耗2molNaOH
难度: 中等查看答案及解析
-
常温下,下列有关溶液的说法正确的是
A. NaHCO3溶液加水稀释,c(Na+)与c(HCO3−)的比值将增大
B. pH=1的一元酸和pH=13的一元碱等体积混合后的溶液中:c(OH−)= c(H+)
C. 0.1 mol·L−1硫酸铵溶液中:c(SO42−)> c(NH4+)> c(H+)> c(OH−)
D. 0.1 mol·L−1的硫化钠溶液中:c(OH−)= c(H+)+ c(HS−)+ c(H2S)
难度: 中等查看答案及解析
-
下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确
选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、I-、Cl-
NaOH溶液
Fe3+ + 3OH- =Fe(OH)3↓
B
K+、ClO-、SO42-
盐酸
H++ClO- =HClO
C
K+、OH-、Cl-
过量SO2
SO2+ OH-=HSO3-
D
H+、Fe2+、 SO42-
Ba(NO3)2溶液
SO42-+ Ba2+ =BaSO4↓
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项正确的是
序列
参加反应的物质
生成物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4……
②
Cl2、FeBr2
只有FeCl3、FeBr3
③
KClO3、HCl(浓)
Cl2……
A. 氧化性由强到弱顺序为KCl03>Cl2>Fe3+>Br2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1:1
C. 第③组反应中生成1molCl2,转移电子2mol
D. 第①组反应的其余产物为H20和02
难度: 困难查看答案及解析
-
短周期元素M、W、X、Y、Z的原子序数依次增大,质子数之和为37。M和W形成的某种化合物可作制冷剂,Y和Z能形成ZY2型离子化合物。下列有关叙述不正确的是( )
A. Y元素没有正价
B. M、W元素组成的化合物中一定只含极性共价键
C. W、X、Y三种元素的简单氢化物稳定性:Y>X>W
D. X和Z形成的化合物ZX2中,阳离子和阴离子的数目之比为1:1
难度: 中等查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是
A. 新制氯水长时间放置颜色变浅
B. 高压比常压更有利于H2转化为NH3
C. 蒸干AlCl3溶液无法得到无水AlCl3
D. 滴加少量CuSO4溶液可以加快Zn与稀H2S04反应的速率
难度: 中等查看答案及解析
-
(题文)对分别盛有不同无色溶液①②③④四支试管进行如下操作。现象和结论对应正确的是
操作
现象
结论
A
向①中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口
试纸变蓝
原溶液中有NH4+
B
向②中滴入NaHCO3溶液
有白色沉淀生成
原溶液中有AlO2-
C
向③中先滴加BaCl2溶液再滴加HCl溶液
生成白色沉淀
原溶液中有SO42-
D
向④中滴加氯水和CCl4,振荡静置
下层溶液呈橙色
原溶液中有I-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl
Ag2SO4
Ag2S
AgBr
AgI
1.8×10-10
1.4×10-5
6.3×10-50
7.7×10-13
8.51×10-16
下列说法不正确的是
A. 氯化银、溴化银和碘化银的溶解度依次减小
B. 将硫酸银溶解于水后,向其中加入少量硫化钠固体,能得到黑色沉淀
C. 在5mL1.5×10-5mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol/L的AgNO3溶液,不能观察到白色沉淀
D. 在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为200mL,溶液中Ag+的物质的量浓度为0.2mol/L。
难度: 困难查看答案及解析
-
2017年9月我国科学家对于可充放电式锌一空气电池研究取得重大进展。电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电的总反应方程式为2Zn+O2+40H-+2H2O=2Zn(OH)2。下列有关说法正确的是( )
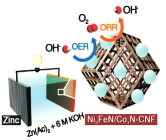
A. 可逆锌一空气电池实际上是二次电池,放电时电解质溶液中K+向负极移动
B. 在电池产生电力的过程中,空气进入电池,发生ORR反应,并释放OH-
C. 发生OER反应的电极反应式为2H2O-4e-=O2+4H+
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应: H2(g)+I2(g)
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器
起始浓度
平衡浓度
c(H2)/(mol·L-1)
c(I2)/(mol·L-1)
c(HI)/(mol·L-1)
甲
0.01
0.01
0.004
乙
0.01
0.02
a
丙
0.02
0.01
b
丁
0.02
0.02
c
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
难度: 困难查看答案及解析
-
25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL (溶液体积有简单叠加),Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. c、d两点,
 值相等
值相等C. a→d点过程中,存在c (X-) =c (NH4+)
D. b点,c(NH4+)+c (HX) = 0.05mol/L
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
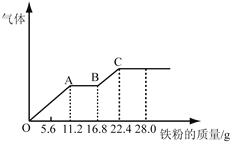
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
难度: 困难查看答案及解析


 ii:
ii: 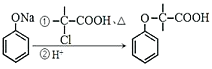
 的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2
的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2 CH3CH2OH
CH3CH2OH