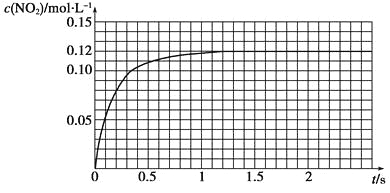
-
法国里昂的科学家发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号”元素。它与天体中的中子星构成类似。有关该微粒说法正确的是( )
A. 该微粒不显电性
B. 该微粒的质量数为2
C. 在元素周期表中与氢元素占同一位置
D. 它与普通中子互称同位素
难度: 中等查看答案及解析
-
“玉兔”号月球车用
Pu作为热源材料。下列关于
Pu的说法不正确的是( )
A.
Pu的原子核外电子数为144 B.
Pu的核内质子数为94
C.
Pu与
Pu的化学性质相同 D.
Pu与
Pu互为同位素
难度: 中等查看答案及解析
-
关于元素周期表的下列叙述,错误的是( )
A. 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一。
B. 在周期表中,把电子层数相同的元素排成一横行,称为一周期
C. 元素周期表中,总共有18个纵行,18个族
D. 第IA族的元素又称为碱金属元素(除了H),第VIIA族的元素又称为卤族元素
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是
A. 锌粒与稀硫酸的反应
B. 甲烷在空气中燃烧的反应
C. 灼热的木炭与CO2的反应
D. Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
难度: 中等查看答案及解析
-
同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则下列判断中错误的是( )
A. 非金属性:X>Y>Z
B. 气体氢化物的热稳定性按X、Y、Z的顺序增强
C. X、Y、Z的最高价氧化物的水化物酸性由强到弱
D. X、Y、Z的最外层电子数依次减少
难度: 简单查看答案及解析
-
下列反应过程中,同时有离子键和共价键的断裂和形成的反应是( )
A. NH4Cl
NH3↑+HC1↑ B. NH3+CO2+H2O=NH4HCO3
C. 2NaBr+Cl2=2NaCl+Br2 D. CuSO4+Fe=Cu+FeSO4
难度: 中等查看答案及解析
-
化学反应一定伴随着能量变化,下列反应的能量变化与下图相符的是
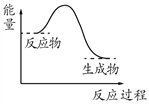
A. 高温煅烧石灰石
B. 氧化钙与水反应
C. 氢气还原氧化铜
D. Ba(OH)2·8H2O晶体与NH4Cl固体的反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B. 常温常压下,7.0 g乙烯与丙烯的混合物中含有碳氢键的数目为NA
C. 50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D. 某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 中等查看答案及解析
-
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
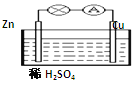
①Zn是负极 ②电子由Zn经外电路流向Cu
③Zn-2e-=Zn2+④溶液中H+向Zn棒迁移
A. ①② B. ①②③
C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
有机物
的正确命名为
A. 3,3,4-三甲基己烷 B. 3,3-二甲基-4-乙基戊烷
C. 2-乙基-3,3-二甲基戊烷 D. 2,3,3-三甲基己烷
难度: 简单查看答案及解析
-
关于铅蓄电池的说法正确的是
A. 在放电时,正极发生的反应是 Pb(s) +SO42—(aq)= PbSO4(s) +2e—
B. 在放电时,该电池的负极材料是铅板
C. 在充电时,电池中硫酸的浓度不断变小
D. 在充电时,阳极发生的反应是 PbSO4(s)+2e—= Pb(s)+ SO42—(aq)
难度: 中等查看答案及解析
-
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的( )
A. 硫酸铜溶液 B. 硝酸钠溶液 C. 醋酸钠溶液 D. 氢氧化钠溶液
难度: 中等查看答案及解析
-
下列反应中,属于取代反应的是( )
A. 乙烯使溴的四氯化碳溶液褪色
B. 苯与浓硝酸、浓硫酸混合共热制取硝基苯
C. 将苯滴入溴水中,振荡后水层接近无色
D. 乙烯使KMnO4溶液褪色
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A. 氯离子的结构示意图:

B. 作为相对原子质量测定标准的碳核素:
C. 氯化镁的电子式:
D. 用电子式表示氯化氢分子的形成过程:
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法正确的是( )
A. 1 L 0.1 mol•L﹣1盐酸和1 L 0.1 mol•L﹣1硫酸分别与1 L 2 mol•L﹣1 NaOH溶液反应速率相同
B. 化学反应速率为0.8 mol•L﹣1•s﹣1,其含义是时间为1s时,某物质的浓度是0.8 mol•L﹣1
C. 0.1 mol•L﹣1盐酸和0.1 mol•L﹣1硝酸与相同形状和大小的大理石反应的速率相同
D. 对于任何化学反应来说,反应速率越大,反应现象就越明显
难度: 中等查看答案及解析
-
从海水中提取部分物质的过程如下图所示,下列有关说法错误的是

A.过程①需要加入化学试剂、沉淀、过滤等操作
B.由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C.工业上一般用电解氯化镁溶液制取Mg单质
D.反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
难度: 中等查看答案及解析
-
下列对有机化合物的说法错误的是( )
A.煤的干馏、石油的分馏分别是化学变化、物理变化
B.棉花、蚕丝、合成纤维的主要成分都是纤维素
C.油脂可看做高级脂肪酸(如硬脂酸、软脂酸等)与甘油经酯化反应生成的酯
D.可以用新制的氢氧化铜悬浊液检验患者尿液中的葡萄糖
难度: 中等查看答案及解析
-
下列过程中所发生的化学反应不属于取代反应的是
A.光照射甲烷与氯气的混合气体
B.在镍作催化剂的条件下,苯与氢气反应
C.乙醇与乙酸在浓硫酸作用下加热
D.苯与液溴混合后撒入铁粉
难度: 中等查看答案及解析
-
在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
A. 10秒时,用O2表示该反应的平均反应速率为0.01mol/(L·s)
B. 当反应达到平衡时,SO3的物质的量可能为0.4mol
C. 档SO2和O2的生成速率之比为2:1时,达到该反应限度
D. 向容器内充入SO2,可以提高反应速率
难度: 中等查看答案及解析
-
取一支大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,用铁架台固定好。放在光亮处一段时间。下列对观察到的现象的描述及说明正确的是 ( )
A. 试管中气体颜色变浅,是因为发生了加成反应
B. 试管中有少量白雾生成,这是氯化氢的小液滴
C. 试管内壁出现油状液体,这是甲烷与氯气的混合溶液
D. 试管内壁出现油状液体,这是CH3Cl小液滴
难度: 中等查看答案及解析