-
在N2+3H2
2NH3反应中,自反应开始至2S末,氮气的浓度由0变为0.4mol/L,则以氮气的浓度变化表示该反应在2S内的平均反应速率是( )
A.0.2mol/L·S B.0.4mol/L·S
C.0.6mol/L·S D.0.8mol/L·S
难度: 中等查看答案及解析
-
我们生活中离不开各种各样的电池,下列关于电池的说法错误的是( )
A.用后不能再生的电池称为一次电池,如锌锰干电池(电解质溶液中含氯化铵等)
B.放电后通过充电可反复使用的电池称为二次电池,如镍镉电池、铅蓄电池等
C.手机、电脑、数码相机中的可充电电池使用寿命长,对环境无害,不用进行回收
D.目前我国生产的无汞干电池,对环境和人体健康没有明显危害,可以不进行特殊处理,和普通垃圾混放
难度: 简单查看答案及解析
-
用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )
A.Cu
Cu(NO3)2 B.Cu
Cu(NO3)2
C.Cu
CuCl2
Cu(NO3)2 D.Cu
CuO
Cu(NO3)2
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.浓硫酸能将炽热的木炭氧化为二氧化碳
B.稀硫酸能按水的组成比脱去蔗糖中的氢、氧元素
C.硫酸和硝酸分别与金属反应时,S和N元素的化合价一定发生变化
D.因为浓硫酸或浓硝酸能与铝反应,所以常温下二者都不能用铝制容器盛装
难度: 中等查看答案及解析
-
已知E与G反应生成L和M,且组成E、G、L、M分子的元素原子序数均小于10,用它们的结构式表示反应如下图所示。则下列判断错误的是( )
+
+
E G L M
A.G是最活泼的非金属单质 B.L分子中有共价键
C.E能使紫色石蕊试液变蓝色 D.M化学性质很活泼
难度: 简单查看答案及解析
-
H2A是二元弱酸,KHA溶液呈酸性。在0.1mol·L-1 KHA溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HA-)+c(OH-)+c(A2-) B.c(HA-)+c(A2-)=0.1mol·L-1
C.c(A2-)>c(H2A) D.c(K+)=c(H2A)+c(HA-)+c(A2-)
难度: 困难查看答案及解析
-
某元素同位素的单质
,极易形成
,下列说法不正确的是( )
A.此气体分子中含有的中子数为b-a
B.此元素的离子中含有的电子数为a+n
C.此气体分子中含有的质子数为c(a+n)
D.一个该同位素原子的质量约为
g
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是( )
A.pH = 0的溶液中:Na+、AlO2-、K+、NH4+
B.由水电离出的c (H+)=10-12mo1/L的溶液中:Cl- 、HCO3-、 NH4+、SO32-
C.加入铝能放出H2的溶液中:Mg2+、 NH4+、 Cl-、SO42-
D.滴加石蕊试液显蓝色的溶液:K+ 、Ba2+ 、NO3- 、OH-
难度: 困难查看答案及解析
-
对原子核外电子以及电子的运动,下列描述正确的是( )
①可以测定某一时刻电子所处的位置 ②电子质量很小且带负电荷 ③运动的空间范围很小 ④高速运动 ⑤有固定的运动轨道 ⑥电子的质量约为氢原子质量的
A.①②③ B.②③④⑥
C.③④⑤⑥ D.⑤⑥
难度: 简单查看答案及解析
-
的名称是( )
A.1,3—二甲基戊烷 B.2—甲基—3—乙基丁烷
C.3,4—二甲基戊烷 D.2,3—二甲基戊烷
难度: 简单查看答案及解析
-
X、Y、Z三种元素的原子序数相连,元素X易获得电子成为稳定的离子,元素Z
易失去电子成为稳定的离子。下列说法中,不正确的是( )
A.Y原子中电子数较X原子多一个,但比Z原子少一个
B.Y单质和Z、X的单质均可以反应
C.元素Z为活泼的金属,其单质跟水反应放出氢气,生成物的水溶液显碱性
D.X原子与氢反应能形成HX
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)= 2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
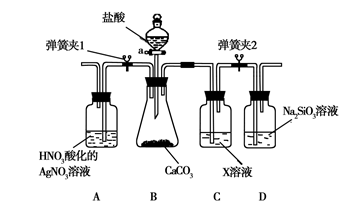
下列装置能达到实验目的的是( )
 ?
? ??
??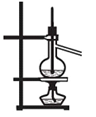 ?
?①???? ② ? ?③ ???④
A.实验室用装置①制取氨气
B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
难度: 中等查看答案及解析
-
下列实验操作不能达到其对应目的的是
编号 实验操作 目的
A 取
加入96mL水中
(水的密度近似看作1g/
) 配置4%
溶液
B 滴定实验中,用待测液润洗锥形瓶 避免造成误差使滴定结果偏低
C 向
溶液中滴入酚酞溶液,加热 证明升高温度能促进
水解
D 向盛有铜片的试管中加入浓硫酸,加热 证明浓硫酸具有强氧化性
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
难度: 中等查看答案及解析